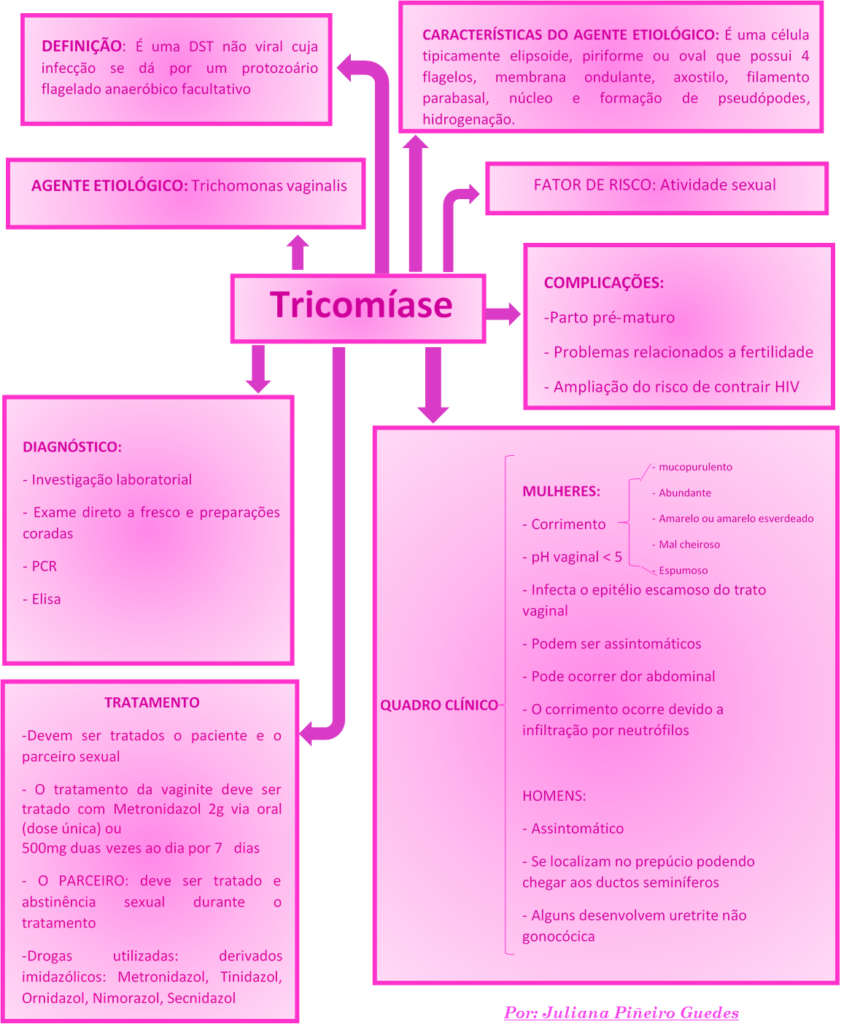
O que é tricomoníase
Trichomonas vaginalis é o causador da doença sexualmente transmissível (DST) não-viral mais comum no mundo, a tricomoníase, também chamada de tricomíase. A Organização Mundial da Saúde (OMS) estimou em 170 milhões os casos de tricomoníase no mundo anualmente em pessoas entre 15 e 49 anos, com a maioria (92%) ocorrendo em mulheres. Apesar da alta prevalência e dos riscos associados à tricomoníase, pouco é conhecido sobre a variabilidade biológica do parasito. O T. vaginalis não é grande causador de seqüelas e, por isso, muitos clínicos têm considerado a doença mais um incômodo do que um problema de saúde pública. Entretanto o T. vaginalis tem se destacado como um dos principais patógenos do homem e da mulher e está associado a sérias complicações de saúde. Publicações recentes mostraram que o T. vaginalis promove a transmissão do vírus da imunodeficiência humana (HIV); é causa de baixo peso em bebês, bem como de nascimentos prematuros; predispõe mulheres a doença inflamatória pélvica atípica, câncer cervical e infertilidade.
A tricomoníase apresenta uma ampla variedade de manifestações clínicas. Os sinais e sintomas dependem das condições individuais, da agressividade e do número de parasitos infectantes. Pode haver sintomas de severa inflamação e irritação da mucosa genital, com presença de corrimento, o que leva a paciente a procurar o médico. Outras vezes a tricomoníase é assintomática e, ocasionalmente, descoberta em um exame de rotina
Morfologia e estrutura
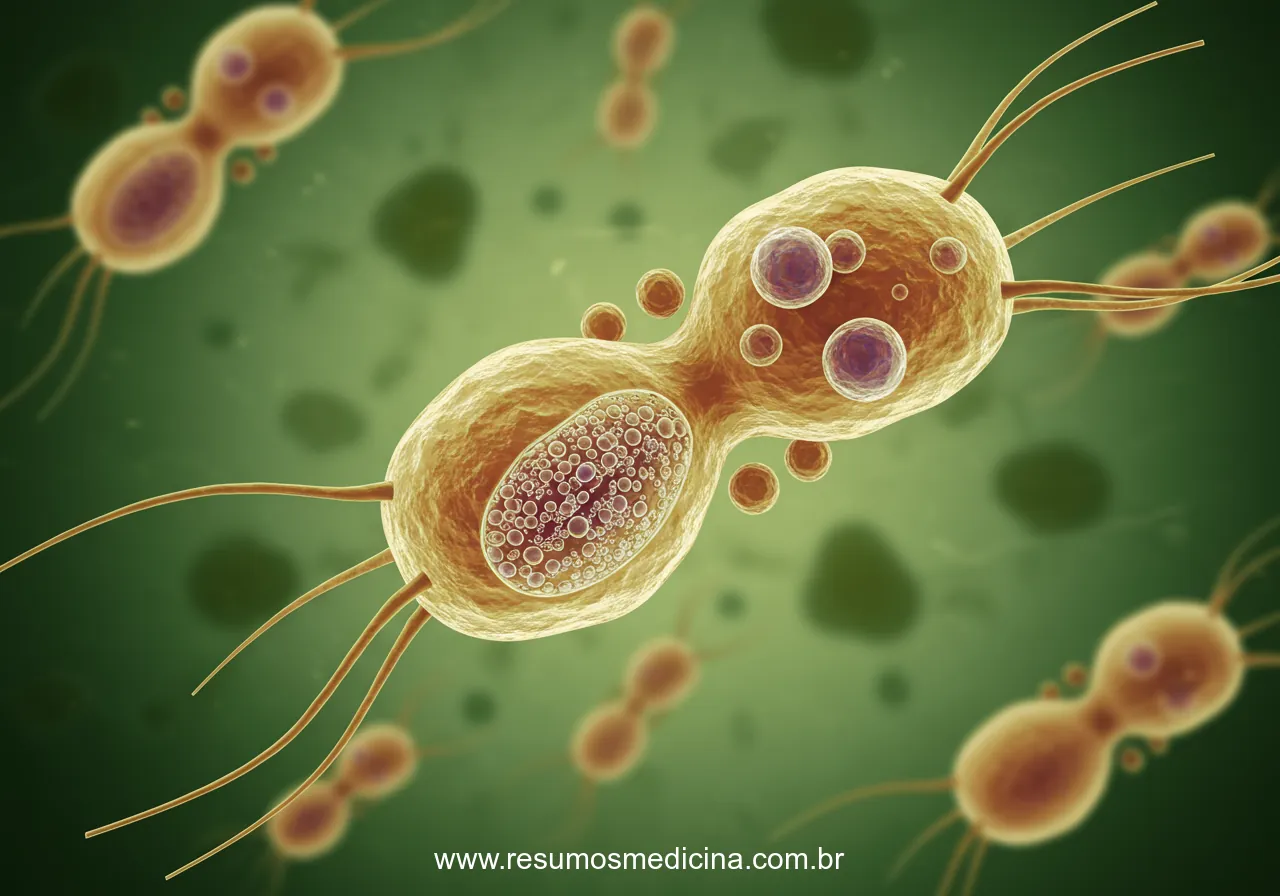
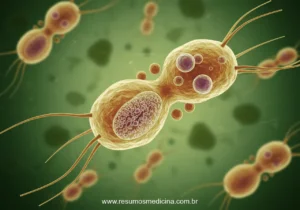
O T. vaginalis é uma célula tipicamente elipsóide, piriforme ou oval em preparações fixadas e coradas. As condições físico-químicas (por exemplo: pH, temperatura, tensão de oxigênio e força iônica) afetam o aspecto dos organismos, que não possuem a forma cística, somente a trofozoítica. O T. vaginalis possui quatro flagelos anteriores, desiguais em tamanho, que partem de uma depressão do pólo anterior, denominada canal períílagelar, e se dirigem para frente. um outro flagelo, recorrente, emerge fora desse canal e fica voltado para trás, mantendo-se aderente em toda a sua extensão ao corpo celular por uma prega que constitui a membrana ondulante, mas não chega até a extremidade posterior. O axóstilo é uma estrutura rígida e hialina, formada por microtúbulos, que se projeta através do centro do organismo, prolongando-se até a extremidade posterior. O núcleo é elipsóide, próximo à extremidade anterior. Esse protozoário é desprovido de mitocôndrias, mas apresenta grânulos densos que podem ser vistos ao microscópio óptico, os hidrogenossomos
A forma do protozoário modifica-se facilmente, pois não existem, sob a membrana, estruturas de sustentação que lhe confiram rigidez. Em meio a uma população de flagelados, aparecem sempre, em maior ou menor número, certos indivíduos que emitem pseudópodes do tipo lobópode ou, mesmo, que assumem aspecto inteiramente amebóide, com flagelos livres ou sem eles.
Trichomonas vaginalis destaca-se por ter dimensões, variando de 10 a 30 pm de comprimento por 5 a 12 pm de largura.
Fisiologia
T. vaginalis vive habitualmente sobre a mucosa vaginal, podendo ser observado em outros lugares do aparelho geniturinário. No homem, já foi encontrado no prepúcio, na uretra e na próstata. Cresce bem em meios artificiais complexos, em temperaturas entre 25 e 40°C e em faixa de pH bastante ampla, com seu ótimo entre pH 5,5 e 6, isto é, em meios nitidamente ácidos. Como fontes energéticas, os parasitos utilizam glicose, frutose, maltose, glicogênio ou amido. A partir dos carboidratos do meio formam suas reservas citoplásmicas de glicogênio, consumindo-as quando se esgotam as fontes externas. A importância dos hidratos de carbono em sua alimentação é aumentada pelo fato de não disporem, aparentemente, de enzimas proteolíticas para digerir as proteínas do meio. Não há ciclo de Krebs completo nem citocromos.
Infectividade e resistência ao parasito
-
Os mecanismos de transmissão de T. vaginalis ainda não estão inteiramente esclarecidos. A propagação pelo coito deve ser a forma mais frequente, visto que o parasito infecta facilmente o homem, alojando-se na uretra, nas vesículas seminais ou na próstata, mesmo quando isso não se acompanhe de manifestações clínicas.
As mães infectadas podem contaminar suas filhas durante a parturição, numa pequena proporção de casos (cerca de 5%).
A vagina normal é notavelmente resistente às infecções e, para alguns autores, a implantação do T.vaginalis estaria associada a modificações do meio vaginal. Dentre as alterações que favoreceriam o desenvolvimento do flagelado, estariam:
• modificações da flora bacteriana vaginal;
• diminuição da acidez local; diminuição do glicogênio, nas células do epitélio;
• acentuada descamação epitelial. Na base dessas modificações poderiam estar fatores hormonais, ou outros processos de natureza inflamatória ou irritativa.
Trichomonas vaginalis pode ser encontrado em mulheres com pH vaginal entre 4 e 8, porém incide com maior frequência entre pH 6 e 6,5. Depois da puberdade os valores normais do pH local estão em tomo de 3,8 e 4,5. Nesse meio fortemente ácido (definido como grau I) proliferam os bacilos de Doderlein, que metabolizam o glicogênio e produzem ácido lático; nessas condições, não se observa em geral a presença de T.vaginalis.
-
A frequência com que se observa a infecção de moças virgens, quando a mãe está parasitada (superior a 80%, em um estudo sobre o assunto), sugere que a propagação da parasitose ocorra muitas vezes pela água ou por fômites (banho, roupa íntima ou de cama, artigos de toalete etc. quando molhados ou incompletamente secos).
Manifestações clínicas
NA MULHER:
O T. vaginalis infecta principalmente o epitélio escamoso do trato genital. A tricomoníase apresenta grande variabilidade de manifestações patológicas, desde a apresentação assintomática até um estado de severa inflamação (vaginite). Das mulheres infectadas, entre 25% e 50% são assintomáticas, têm pH vaginal normal de 3,8 a 4,2 e flora vaginal normal. Um terço das pacientes assintomáticas torna-se sintomático dentro de seis meses. É uma doença de idade reprodutiva e raramente as manifestações clínicas da infecção são observadas antes da menarca ou após a menopausa.
Mulheres com vaginite aguda causada por T. vaginalis freqüentemente têm corrimento devido a infiltração por leucócitos. A consistência do corrimento varia de acordo com a paciente, de fino e escasso a espesso e abundante. O sintoma clássico de corrimento amarelo, abundante, espumoso e mucopurulento ocorre em somente 20% dos casos. Há também odor vaginal anormal e prurido vulvar. A vagina e a cérvice podem ser edematosas e eritematosas, com erosão e pontos hemorrágicos na parede cervical conhecidos como colpitis macularis ou cérvice com aspecto de morango. Embora essa aparência seja altamente específica para tricomoníase, é vista somente em poucas mulheres (2% a 5%). Dor abdominal tem sido relatada entre muitas mulheres com tricomoníase e pode ser indicativa de infecção do trato urogenital superior.
A severidade da tricomoníase pode também induzir estados citopatológicos de displasia/metaplasia, já que a infecção foi detectada freqüentemente (39%) em mulheres com neoplasia intra-epitelial cervical (CIN).
Recentes publicações indicam que o impacto da tricomoníase não é limitado a vaginites – micoplasmas e Neisseria gonorrhoeae são fagocitados por T. vaginalis, e segmentos de RNA viral têm sido encontrados em certas linhagens do parasito. É possível, então, que o protozoário possa atuar também como vetor para outros patógenos.
Na infecção crônica, os sintomas são leves, com secreção vaginal escassa. Essa forma é particularmente importante do ponto de vista epidemiológico, pois esses indivíduos são a maior fonte de transmissão do parasito.
NO HOMEM:
Diferentemente da mulher, homens infectados pelo contato com parceira sexual infectada, por razão desconhecida podem ter somente infecção autolimitada.
A tricomoníase em homens pode ser classificada em três grupos: estado assintomático; estado agudo, caracterizado por uretrite purulenta abundante; e doença assintomática leve, clinicamente indistinguível de outras causas de uretrite.
No estado sintomático há escasso corrimento, disúria, prurido, ulceração peniana e sensação de queimação imediatamente após a relação sexual. Complicações são raras, mas podem incluir epididimite, infertilidade e prostatite.
Muitos homens com idade entre 16 e 22 anos apresentaram-se positivos para tricomoníase quando submetidos a massagem prostática. Dessa forma, o exame do sedimento urinário, rotineiramente utilizado para o diagnóstico de tricomonas em homens, pode induzir falsos resultados se não for acompanhado de massagem prostática.
A significância clínica da tricomoníase em homens parece ser controversa, visto que muitos homens infectados são assintomáticos. No entanto, foi observada inflamação uretral com uretrite não-gonocócica. O zinco é altamente tóxico para T. vaginalis, e é possível que muitos homens refratários a esta infecção tenham quantidades consideráveis deste metal no fluido prostático.
OBS: Há pacientes que não apresentam queixa alguma, e o exame ginecológico demonstra a existência de lesões discretas. Outras exibem alterações de importância maior ou menor, acompanhadas de sintomas. Algumas vezes produzem-se erosões da superfície da mucosa, na vagina e na uretra, com intensa reação inflamatória que chega até o cório. O infiltrado inflamatório contém principalmente neutrófilos e alguns eosinófilos. Das manifestações objetivas, a mais frequente é leucorréia, que, em mulheres adultas, consiste na produção de um corrimento abundante, geralmente esbranquiçado e sem sangue, podendo ter origem na vulva, na vagina, no fúndus ou na cérvix uterina.
OBS: O diabetes é uma doença causada pelo aumento da glicose (açúcar) na corrente sanguínea. Essa glicose é justamente uma das fontes de energia do parasito da Tricomoníase, logo, em um ambiente repleto de glicose, como é o caso dos diabéticos, vai ocorrer uma maior propensão de ocorrer a doença, que por fim, tem como característica o corrimento vaginal nas mulheres.
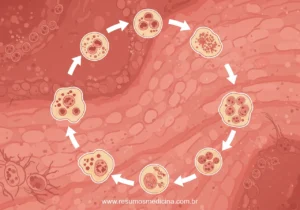
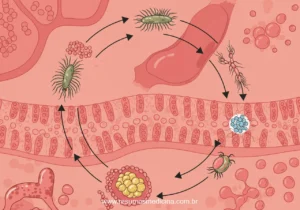
Ciclo Biológico da Tricomoníase
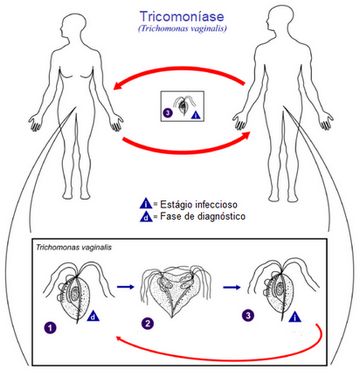
1 – O protozoário habita o baixo trato genital feminino e a uretra e a próstata masculina; 2 – Nos locais mencionados, o protozoário se multiplica por fissão binária e gera colônias. No ambiente externo ao corpo do indivíduo, ele não é capaz de sobreviver; 3- A transmissão acontece apenas entre humanos, que são seus hospedeiros naturais.
Resposta Imune Inata
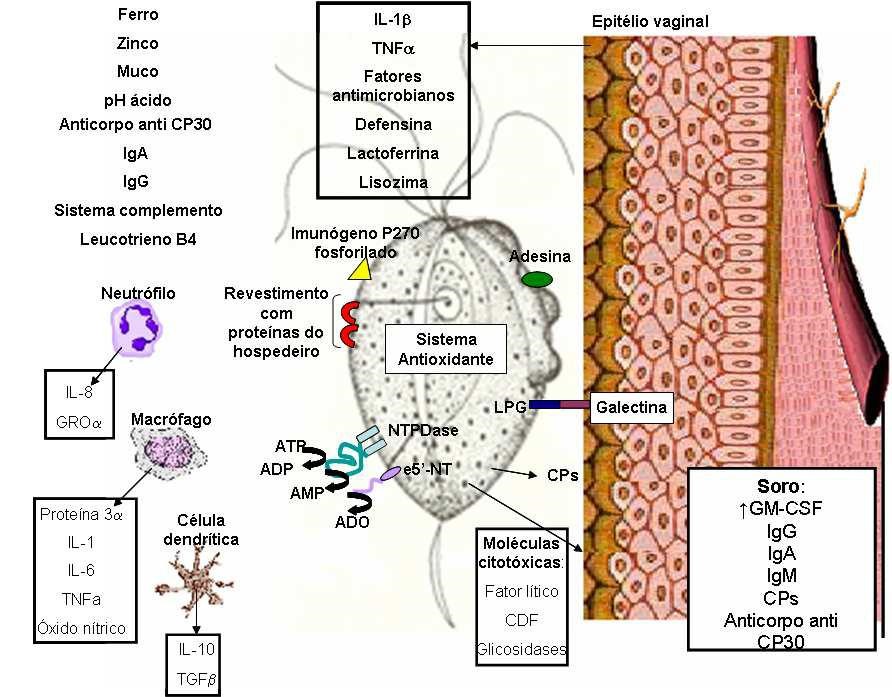
A infecção por T. vaginalis é frequentemente recorrente, sem imunidade permanente, sugerindo a importância da resposta imu ne inata (Fichorova, 2009). Esta é considerada a primeira linha de defesa contra microrganismos da mucosa vaginal, parte via indução de citocinas pró-inflamatórias e fatores antimicrobianos, parte por estimulação da resposta imune adaptativa (Cauci & Culhane, 2007).
O epitélio vaginal, o muco e o pH ácido em torno de 4,5 são integrantes do sistema de resposta imune inata vaginal (de Lima & Alves, 2008). O epitélio atua como barreira física contra a progressão do parasito na mucosa vaginal, participa ativamente da secreção de substâncias antimicrobianas e fatore s imunes como defensina, lactoferrina e lisozima (de Lima & Alves, 2008) e produz quimiocinas em resposta à adesão espécie-específica de T. vaginalis.
O lipofosfoglicano (LPG), glicoconjugado mais abundante da superfície celular de T. vaginalis, liga-se a uma proteína da classe das galectinas presente nas células epiteliais de maneira carboidrato-dependente e assim estabelece a adesão espécie-específica do parasito (Okumura et al., 2008). Ocorre então uma resposta inflamatória específica e uma “upregulation” de quimiocinas selecionadas pelas células epiteliais vaginais e cervicais humanas de maneira Toll-like receptor (TLR) 4 independente (Fichorova, 2009).
A ação das quimiocinas ocorre via receptores específicos da superfície celular do hospedeiro que apresentam sete domínios transmembrana, membros da família de receptores acoplados à proteína G (Brenier-Pinchart et al., 2001). Quimiocinas envolvidas na resposta inflamatória a T. vaginalis incluem a proteína inflamatória 3a de macrófagos (Fichorova, 2009), leucotrieno B4 e interleucina (IL) 8 em pacientes sintomáticos (Ryu et al., 2004; Kucknoor et al., 20 07).
A IL-8 é o mais potente quimioatraente para neutrófilos e macrófagos e a sua presença no fluido vaginal é indicativo de condições inflamatórias agudas e crônicas no baixo trato genital feminino (Singh et al., 2009). A sua secreção é induzida por componentes da membrana do parasito de forma parcialmente dependente do fator de necrose tumoral alfa (TNFa) (Brenier-Pinchart et al., 2001) e é maior em pacientes sintomáticos comparados a assintomáticos para a tri comonose (Ryu et al., 2004).
Além de ser produzida pelas células do epitélio vaginal, a IL-8 também é produzida pelos neutrófilos humanos estimulados por T. vaginalis (Ryu et al., 2004). Essa produção é dose- e tempo-dependente da infecção pelo parasito (Brenier-Pinchart et al., 2001) e tem um efeito biológico prolongado no recrutamento de neutrófilos (Ryut al., 2004). O oncogene regulador do rescimento alfa (GRO-a) é outra quimiocina produzida por neutrófilos humanos em resposta à ativação por T. vaginalis, embora a quantidade produzida seja bem menor do que a de IL-8. Ambas induzem infiltração e recrutamento de neutrófilos por quimiotaxia ao sítio de reação. O acúmulo destes causa inflamação continuada e/ ou inflamação vaginal agravada (Ryu et al., 2004).
A IL-8 é positivamente associada com a IL-1, a interleucina pró-inflamatória responsável por uma cascata de resposta imune inata e adaptativa. Muitas evidências indicam a IL-1 como uma interleucina crucial que deve mediar os efeitos adversos relacionados com o trato reprodutivo. A IL-1 aumenta em resposta a vários estímulos, incluindo uma variedade de patógenos, entre eles o T. vaginalis, que aumenta significantemente a produção do subtipo IL-1b (Cauci & Culhane, 2007).
A IL-8 é positivamente associada com a IL-1, a interleucina pró-inflamatória responsável por uma cascata de resposta imune inata e adaptativa. Muitas evidências indicam a IL-1 como uma interleucina crucial que deve mediar os efeitos adversos relacionados com o trato reprodutivo. A IL-1 aumenta em resposta a vários estímulos, incluindo uma variedade de patógenos, entre eles o T. vaginalis, que aumenta significantemente a produção do subtipo IL-1b (Cauci & Culhane, 2007).
A IL-1b está presente em grandes quantidades no meio intra celular de células epiteliais e assim como o TNF-a, presente em menores quantidades, é liberada quando ocorre um dano ao epitélio celular. Tanto IL-1b quanto TNF-a agem como agonistas de TLRs expressos por células da imunidade inata e induzem a ativação do fator nuclear (NF) kB que, tratando-se de um fator de transcrição, induz a expressão de citocinas pró-inflamatórias, quimiocinas e defensinas na resposta inflamatória induzida por T. vaginalis (Fichorva et al., 2006; de Lima & Alves, 2008).
O aumento dos níveis de IL-1, IL-8 e também de neutrófilos foi verificado em casos de vaginose bacteriana com coinfecção por T. vaginalis, o que não ocorre em coinfecções por Chlamydia trachomatis, Neisseria gonorrhoeae e fungos (Cauci & Culhane, 2007). Anderson e colaboradores (2007) encontraram a concentração sérica do fator estimulador de colônias de granulócitos e macrófagos (GM-CSF), uma interleucina que aumenta a produção de granulócitos, macrófagos e células dendríticas, significantemente maior no grupo de mulheres grávid as infectadas por T. vaginalis. O mesmo não foi constatado no grupo de mulheres infec tadas por Neisseria gonorrhoeae ou por Chlamydia trachomatis, sugerindo que a produção de GM-CSF é especificamente relacionada à tricomonose (Anderson et al., 2007).
O GM-CFS, assim como outros mediadores inflamatórios, incluindo IL-1a, fator estimulador de colônia de granulócitos (G-CSF) e popolissacarídeos, atuam prolongando o tempo de vida de neutrófilos polimorfonucleares. Esse é um mecanismo importante para a imunidade do hospedeiro uma vez que neutrófilos apresentam um tempo de vida curto no sangue e desencadeiam apoptose espontânea dentro de um período de 24 horas (Song et al., 2010).
A atividade dos neutrófilos na infecção por T. vaginalis está intimamente ligada à ativação da via alternativa do sistema complemento uma vez que o neutrófilo, pelo seu receptor C3b, consegue ligar-se ao C3b desse sistema com o parasito previamente aderido. Além disso, o fragmento C3a, também liberado nesse processo, é quimioatraente para neutrófilos (Honigberg, 1990). Essa ativação do sistema complemento é desencadeada pelo próprio parasito, o que promove uma explicação satisfatória para a falha da disseminação da infecção pela corrente sanguínea (Honigberg, 1990).
A infecção por T. vaginalis ativa receptores TLR4 (Fichorova, 2009) que desempenham função crítica na resposta imune inata reconhecendo patógenos (Chaplin, 2010). A indução de uma atividade estimulatória de TLR4 no trato genital pela infecção causada por T. vaginalis pode resultar na estimulação de células recrutadas para o trato genital ou de células do próprio trato genital. No entanto, interessantemente, as células epiteliais da vagina humana normal, ectocérvice e endocérvice não expressam TLR4, o que sugere que elas não são estimuladas por este mecanismo na infecção por T. vaginalis. A migração de leucócitos para o trato genital estabelece uma resposta inflamatória uma vez que neutrófilos, monócitos e macrófagos expressam TLR4. Essa fase da resposta pode levar a tricomonose de assintomática à sintomática (Zariffard et al., 2004).
Os macrófagos desempenham uma função chave na resposta imune inata contra vários patógenos. Sabe-se que muitas funções dos ma crófagos são dependentes de processos de fosforilação de tirosina. Para tanto, a maioria dos receptores de superfície de eucariotos empregam pelo menos uma cascata de quinases de proteína mitogênica ativada (MAP) para a sinalização intracelular. A cultura concomitante de T. vaginalis e macrófagos ativa as MAP quinases e a fosforilação da tirosina de várias proteínas (Ryang et al., 2004).
Na inflamação por T. vaginalis, os macrófagos humanos produzem citocinas pró-inflamatórias como IL-1, IL-6 e TNFa e óxido nítrico, via NFkB. A IL-1b e o TNFa produzidos desempenham função crucial in vivo como mediadores no recrutamento tecidual de neutrófilos ao sítio de infecção vaginal da tricomonose em mulheres (Han et al., 2009).
Resposta Imune Adaptativa
Concomitantemente à resposta imune inata ocorre a resposta imune adaptativa do hospedeiro frente à tricomonose. A resposta inata contribui para a ativação da resposta imune adaptativa e esta, por sua vez, aumenta sua intensidade recrutando a resposta imune inata (Chaplin, 2010).
Embora em alguns casos da doença tenha sido reportada a ausência de anticorpos vaginais detectáveis (Abraham et al., 19 96), a infecção por T. vaginalis em humanos resulta em anticorpos parasito-específicos no trato reprodutivo (Schwebke & Burgess, 2004). Somente as classes de imunoglobulinas (Ig) A e G foram detectadas nas secreções vaginais de mulheres com tricomonose aguda (Yadav et al., 2005). IgE, se encontrada no trato genital, ocorre em baixa concentração (Honigberg BM, 1990). Em homens, anticorpos IgG1 e IgM detectados podem estar envolvidos no estabelecimento de tricomonose sintomática, compara dos aos casos assintomáticos (Imam NF et al., 2007).
O papel da IgG nas secreções mucosas é contraditório. Esse isotipo pode atuar tanto como protetor quanto mediador de citotoxicidade, respectivamente pela sua capacidade de ativar as proteínas do complemento e de induzir a citotoxicidade via receptor Fc nos polimorfonucleares, o que é nocivo para o epitélio da mucosa vaginal (de Lima & Alves, 2008).
Na maioria dos casos de tricomonose a presença de anticorpos também é detectada no soro do indivíduo infectado (Schwebke & Burgess, 2004). IgG contra vários tipos de cisteína proteases do parasito foi encontrada (Yadav et al., 2005). A IgA possui um mecanismo descrito pelo qual potencializa o efeito de opsonização por IgG na fagocitose de células alvo de leucócitos polimorfonucleares do sangue periférico de humanos (Honigberg BM, 1990). Além destas, a IgM também é encontrada no soro de pacientes com tricomonose. A IgE nunca é encontrada no soro (Honigberg BM, 1990).
Essa imunidade sistêmica, segundo alguns autores, e xerce um importante papel na imunidade da mucosa do trato genital uma vez que uma porção considerável de IgG e IgA presente neste sítio não é produzida por ele e que a quantidade de Igs presente nas secreções cervicovaginais é fortemente regulada por hormônios. Portanto, a quantidade de Igs varia durante o ciclo menstrual, com uma acentuada diminuição nos níveis durante o período de ovulação (de Lima & Alves, 2008).
Profilaxia
Incontestavelmente, o mecanismo de contágio da tricomoníase é a relação sexual, portanto o seu controle é constituído pelas mesmas medidas preventivas tomadas no combate às outras DSTs. Na abordagem dos pacientes com DST, são essenciais dados sobre data do último contato sexual, número de parceiros, hábitos e preferências sexuais, uso recente de antibióticos, métodos anticoncepcionais e história pregressa deste tipo de doença. Convém salientar que a presença de uma DST é fator de risco para outras Portanto, as medidas indicadas são:
- Prática do sexo seguro com uso de preservativos
- Evitar contato com parceiros infectados
- Tratamento imediato do casal
Controle
- Diagnóstico em pacientes assintomáticos
- Triagem de mulheres sexualmente ativas
- Tratamento dos doentes
Tratamento
Devem ser tratados o paciente e o parceiro
-Drogas utilizadas: derivados imidazólicos
- Metronidazol
- Tinidazol
- Ornidazol
- Nimorazol
- Secnidazol
- Metronidazol 2g via oral (dose única) ou 500mg duas vezes ao dia por 7 dias
Diagnóstico
Clínico:
– Difícil diferenciar de outras DSTs
Parasitológico:
- Exame direto à fresco (exame de rotina usual)
- Exame de esfregaços fixados e corado
– Giemsa, Leishman, Imunoperoxidase, Hematoxilina férrica, etc
- Cultura
- Imunológico:
- Importante para identificar pacientes
Assintomáticos:
- Aglutinação, Imunofluorescência e ELISA
Coleta de Amostras
- Homem:
– Matinal, antes de urinar, sem uso de medicamento
– Material: secreção uretral, sêmen, urina,
secreção prostática e material sub-prepucial
- Mulher:
– Antes da higiene vaginal (18-24h), sem
tratamento anterior com medicação oral,
cremes ou géis.
– Material: secreção vaginal ou cervical
Mapa Mental da Tricomíase
Bibliografia
- Aspectos clínicos, patogênese e diagnóstico de Trichomonas vaginalis
- https://www.lume.ufrgs.br/handle/10183/26830
- http://www.scielo.mec.pt/scielo.php?script=sci_arttext&pid=S0870-90252011000100005