Introdução
DHGNA é um grupo de condições que têm em comum a presença de esteatose hepática (fígado gorduroso) em indivíduos que não consomem álcool ou o fazem em quantidades muito pequenas (menos de 20 g de etanol/semana).
A DHGNA inclui esteatose hepática simples, esteatose acompanhada por inflamação mínima e inespecífica e a esteato-hepatite não alcoólica (EHNA). Esteatose com ou sem uma inflamação inespecífica geralmente é uma condição estável, sem problemas clínicos significativos.
Em contraste, a EHNA é uma condição na qual ocorre lesão de hepatócitos, a qual pode progredir para cirrose em 10% a 20% dos casos.
Os principais componentes da EHNA são tumefação de hepatócitos, inflamação lobular e esteatose.Fibrose ocorre na doença progressiva.
A EHNA afeta homens e mulheres igualmente, e a condição está fortemente associada a obesidade e outros componentes da síndrome metabólica, como dislipidemia, hiperinsulinemia e resistência à insulina. Estima-se que mais de 70% dos indivíduos obesos apresentem alguma forma de DHGNA. Esta é a causa mais comum da chamada cirrose criptogênica, ou seja, cirrose de origem “desconhecida”. A DHGNA contribui para a progressão de outras doenças hepáticas, como a infecção por HCV e CHC.
Patogenia
Os mecanismos precisos da esteatose e da lesão hepatocelular na DHGNA não são totalmente conhecidos, porém a genética e o ambiente desempenham um papel em sua patogenia. Um modelo de “dupla agressão” foi proposto para a patogenia, englobando dois eventos sequenciais: acúmulo de gordura hepática e estresse oxidativo hepático.
O estresse oxidativo age sobre os lípides hepáticos acumulados, resultando em peroxidação de lípides e liberação de peróxidos lipídicos, que podem produzir espécies reativas de oxigênio.
Aspectos Clínicos
Os indivíduos com esteatose simples geralmente são assintomáticos. A apresentação clínica muitas vezes está relacionada com outras perturbações metabólicas, como obesidade, resistência à insulina e diabetes. Estudos de imagem podem revelar o acúmulo de gordura no fígado.
Contudo, a biópsia hepática é a ferramenta diagnóstica mais confiável para EHNA e ajuda a determinar a extensão da esteatose, a presença de esteato-hepatite e o grau de fibrose.
AST e ALT estão elevadas no soro em aproximadamente 90% dos pacientes com EHNA. A razão AST/ALT em geral é menor que 1, em contraste com a esteato-hepatite alcoólica, na qual a razão geralmente está acima de 2,0 a 2,5.
Apesar das elevações enzimáticas, os pacientes podem ser assintomáticos. Outros apresentam sintomas gerais, como fadiga e desconforto abdominal do lado direito causado pela hepatomegalia. Pela associação entre EHNA e a síndrome metabólica, a doença cardiovascular é uma causa de morte frequente em pacientes com EHNA.
A meta do tratamento para indivíduos com EHNA é reverter a esteatose e prevenir cirrose. A estratégia terapêutica atual busca corrigir os fatores de risco subjacentes, como obesidade e hiperlipidemia, e tratar a resistência à insulina.
Morfologia
A esteatose geralmente envolve mais de 5% dos hepatócitos e, às vezes, mais de 90%. Gotículas grandes (macrovesicular) e pequenas (microvesicular) de gordura, predominantemente triglicerídeos, são acumuladas nos hepatócitos.
Na extremidade mais clinicamente benigna do espectro, não há inflamação hepática apreciável, morte de hepatócitos ou cicatrização, apesar da elevação persistente das enzimas hepáticas no soro.
A esteato-hepatite (EHNA) é caracterizada por esteatose e inflamação parenquimatosa multifocal, principalmente neutrófilos, corpos de Mallory, destruição de hepatócitos (tanto degeneração em balão quanto apoptose) e fibrose sinusoidal. Ocorre, também, fibrose nos tratos portais e ao redor das vênulas hepáticas terminais.
Essas alterações histológicas são semelhantes às da esteato-hepatite alcoólica. Uma cirrose pode se desenvolver, supostamente como resultado de anos de progressão subclínica dos processos necroinflamatórios e fibróticos. Quando a cirrose é estabelecida, a esteatose ou esteato-hepatite tende a ser reduzida e, algumas vezes, não é identificável.
Uso de Metformina
Não sofre metabolização hepática nem excreção biliar, tendo eliminação renal intacta.
A função hepática comprometida limita, significativamente, a capacidade do fígado de depurar o lactato. Nessa circunstância, a metformina pode desencadear ou contribuir para o aparecimento de acidose láctica, complicação metabólica potencialmente fatal.
A acidose lática relacionada ao uso de metformina é rara e tem sido mencionada, na maioria das vezes, em indivíduos nos quais o fármaco estaria contraindicado, tais como doença crônica do fígado com elevação de transaminases duas a três vezes os VMR, insuficiência cardíaca, respiratória ou renal.
A metformina não é aconselhada aos usuários de álcool.
Carcinoma Hepatocelular
Patogenia:
Foram estabelecidos quatro fatores etiológicos principais associados ao CHC: infecção viral crônica (HBV, HCV), alcoolismo crônico, esteato-hepatite não alcoólica (EHNA) e contaminantes alimentares (primariamente afl atoxinas).
Outras condições incluem tirosinemia, doenças de depósito de glicogênio, hemocromatose hereditária, doença hepática gordurosa não alcoólica e deficiência de α1-antitripsina. Muitos fatores, incluindo fatores genéticos, idade, gênero, compostos químicos, hormônios e nutrição, interagem no desenvolvimento do CHC.
A doença que apresenta maior probabilidade de originar CHC é a extremamente rara tirosinemia hereditária, na qual quase 40% dos pacientes desenvolvem o tumor, apesar de um controle dietético adequado.
A patogenia do CHC pode ser diferente em populações de alta incidência, com prevalência de HBV, em comparação com populações ocidentais de baixa incidência, nas quais outras doenças hepáticas crônicas como alcoolismo, esteato-hepatite não alcoólica, infecção crônica por HCV e hemocromatose são mais comuns.
Em regiões de alta prevalência, a infecção por HBV começa na infância pela transmissão vertical do vírus de mães infectadas, o que confere um risco 200 vezes maior de desenvolvimento de CHC na idade adulta.
A cirrose pode estar ausente em até metade desses pacientes, e o câncer frequentemente ocorre entre 20 e 40 anos de idade.
A cirrose pode estar ausente em até metade desses pacientes, e o câncer frequentemente ocorre entre 20 e 40 anos de idade.
Embora os mecanismos precisos de carcinogênese sejam desconhecidos, vários eventos foram implicados. Ciclos repetidos de morte e regeneração celular, que ocorrem na hepatite crônica decorrente de qualquer causa, são importantes na patogenia dos CHCs.
Acredita-se que o acúmulo de mutações durante ciclos contínuos de divisão celular possa danificar os mecanismos de reparo de DNA e, eventualmente, transformar os hepatócitos. As alterações pré-neoplásicas podem ser reconhecidas morfologicamente pela ocorrência de displasia dos hepatócitos. A progressão para o CHC pode resultar de mutações pontuais em genes celulares selecionados, como KRAS e p53, e da expressão constitutiva de c-MYC, c-MET (o receptor para o fator de crescimento de hepatócitos), TGF-α e o fator de crescimento semelhante à insulina 2.
A análise molecular das células tumorais em indivíduos infectados por HBV mostrou que a maioria dos nódulos é clonal com relação ao padrão de integração de HBV DNA, sugerindo que a integração viral preceda ou acompanhe um evento de transformação. Na carcinogênese induzida por HBV, não apenas a degeneração do genoma celular causada pela integração viral, mas também o local de integração pode ser importante.
Dependendo do local de integração, a integração do HBV pode ativar proto-oncogenes que contribuem para a tumorigenicidade. Alternativamente, foi proposto que a proteína HBV X, um ativador da transcrição de múltiplos genes, possa ser a principal causa da transformação celular.
O HCV é um vírus RNA que não degenera o DNA e não produzproteínas oncogênicas. Contudo, existem indicações de que as proteínas do núcleo do HCV e NS5A possam participar do desenvolvimento do CHC.
Morfologia:
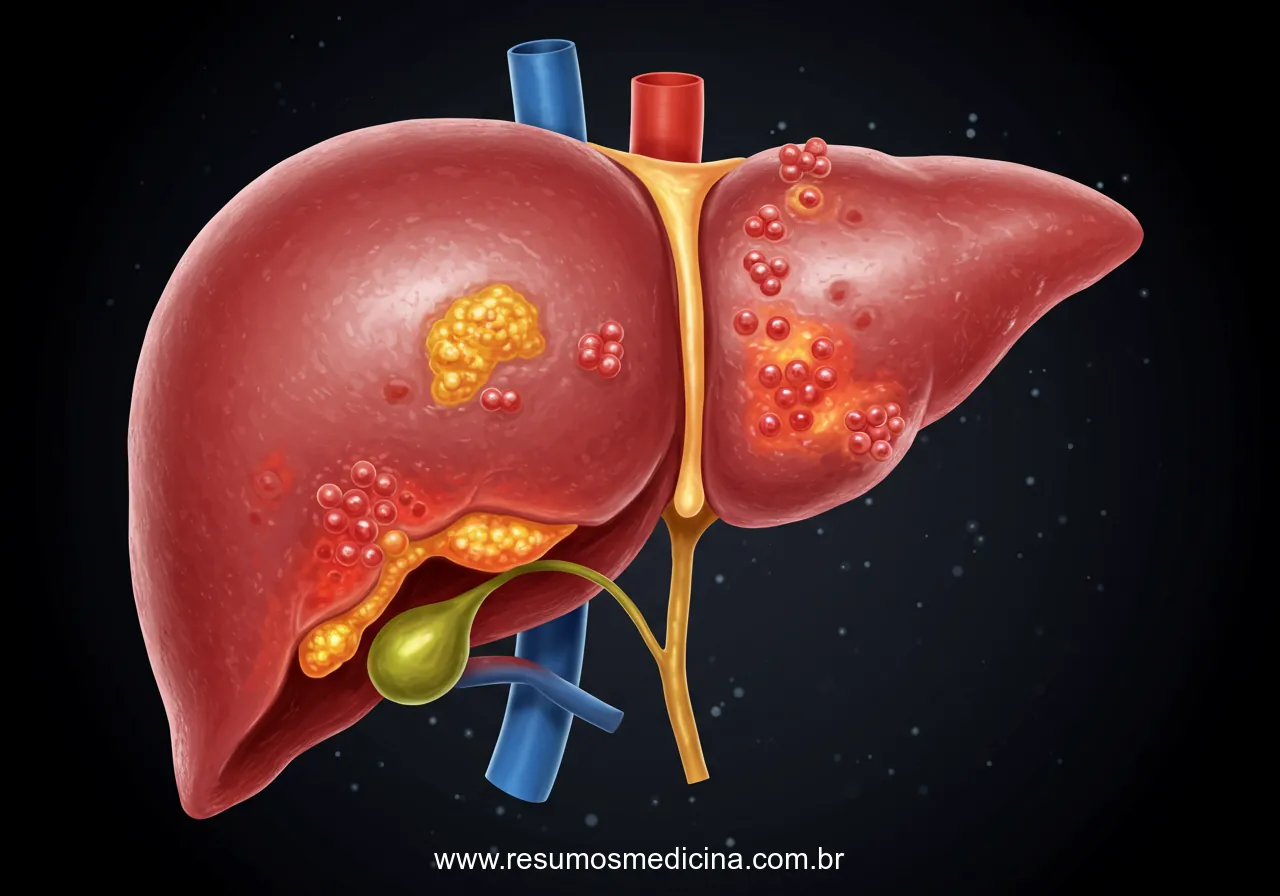
O CHC pode aparecer macroscopicamente como massa unifocal (geralmente grande), nódulos multifocais de tamanho variável, amplamente distribuídos ou um câncer difusamente infiltrativo, permeando extensamente e, às vezes, envolvendo todo o fígado.
Todos os três padrões podem causar aumento do fígado, particularmente os padrões unifocal grande e multinodular. O tumor difusamente infiltrativo pode se misturar de modo imperceptível a um fígado cirrótico subjacente.
Os CHCs geralmente são mais pálidos que o fígado circundante e algumas vezes assumem um tom esverdeado, quando compostos por hepatócitos bem diferenciados capazes de secretar bile. Todos os padrões de CHC apresentam uma forte propensão à invasão de estruturas vasculares.
Metástases intra-hepáticas extensas ocorrem em seguida, e, ocasionalmente, longas massas serpiginosas de tumor invadem a veia porta (com oclusão da circulação portal) ou a veia cava inferior, podendo se estender até mesmo para o lado direito do coração.
O CHC exibe extensa disseminação no fígado por crescimento contíguo óbvio e pelo desenvolvimento de nódulos satélites, cuja origem do tumor original pode ser demonstrada por métodos moleculares.
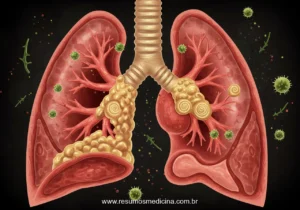
As metástases para fora do fígado ocorrem primariamente por invasão vascular, especialmente do sistema da veia hepática, porém as metástases hematogênicas, especialmente para o pulmão, tendem a ocorrer tardiamente na doença. Metástases para os linfonodos, envolvendo os linfonodos peri-hilares, peripancreáticos e para-aórticos acima e abaixo do diafragma, são encontradas em menos da metade dos CHCs que se disseminam além do fígado.
Os CHCs variam de lesões bem diferenciadas a não diferenciadas e altamente anaplásicas. Em tumores bem e moderadamente diferenciados, células com origem reconhecível nos hepatócitos estão dispostas em um padrão trabecular (lembrando as placas de células hepáticas) ou em um padrão acinar, pseudoglandular. Nas formas pouco diferenciadas, as células tumorais podem assumir um aspecto pleomórfico, com numerosas células gigantes anaplásicas, podem ser pequenas e completamente não diferenciadas ou podem parecer um sarcoma de células fusiformes.
Aspectos Clínicos:
As manifestações clínicas do CHC raramente são características e, na população ocidental, muitas vezes são mascaradas por aquelas relacionadas com cirrose ou hepatite crônica subjacente. Em áreas de alta incidência como a África tropical, os pacientes geralmente não têm história clínica de doença hepática, embora uma cirrose possa ser detectada na autópsia.
Nas duas populações, a maioria dos pacientes apresenta dor abdominal alta pouco definida, mal-estar, fadiga, perda de peso e, às vezes, a percepção de massa abdominal ou plenitude abdominal. Em muitos casos, o fígado aumentado pode ser percebido à palpação, com irregularidade ou nodularidade suficiente para permitir a diferenciação de uma cirrose. Icterícia, febre e sangramento gastrointestinal ou de varizes esofágicas são achados inconstantes.
Níveis elevados de α-fetoproteína sérica são encontrados em 50% das pessoas com CHC. Contudo, resultados falsos-positivos são encontrados em tumores do saco vitelino e em muitas condições não neoplásicas, incluindo cirrose, necrose hepática maciça (com regeneração compensatória das células hepáticas), hepatite crônica (especialmente na infecção por HCV), gravidez normal, sofrimento ou morte fetal e defeitos do tubo neural fetal, como anencefalia e espinha bífida.
Recentemente, a coloração para Glipicano-3 tem sido usada para distinguir precocemente o CHC de nódulos displásicos.
O curso natural do CHC envolve o crescimento progressivo da massa primária até que esta perturbe seriamente a função hepática ou sofra metástase, geralmente primeiro para os pulmões e, então, para outros locais.
Em geral, a morte ocorre em decorrência de caquexia, sangramento gastrointestinal ou de varizes esofágicas,
insuficiência hepática com coma hepático ou, raramente, ruptura do tumor com hemorragia fatal.
Tumores pequenos podem ser removidos cirurgicamente com bons resultados prognósticos. A ablação por radiofrequência é usada para o controle local de grandes tumores, e a quimioembolização também pode ser usada, de acordo com um algoritmo clínico amplamente adotado. Descobertas recentes mostram que o inibidor de quinase sorafenibe pode prolongar a vida de indivíduos com CHC em estágio avançado.
Bibliografia
Bases Patológicas das Doenças, Robbins, 8ª edição.