A Puberdade Precoce Periférica (PPP), também designada como pseudopuberdade precoce ou puberdade precoce independente de GnRH (gonadotrofina-independente), é uma condição endocrinológica caracterizada pela produção autônoma de esteroides sexuais – estrogênios ou andrógenos. Esta produção hormonal excessiva tem origem em fontes gonadais (ovarianas ou testiculares) ou extragonadais, como as glândulas adrenais, ou ainda resulta da exposição exógena a estes hormônios sexuais. Este artigo explora as etiologias tumorais, a Hiperplasia Adrenal Congênita, a Síndrome de McCune-Albright, o Hipotireoidismo Primário Grave e os métodos de diagnóstico da PPP.
Definição e Fisiopatologia da Puberdade Precoce Periférica (PPP)
Fisiopatologicamente, a PPP é definida pela sua independência em relação à ativação do eixo hipotálamo-hipófise-gonadal (HHG). Diferente da Puberdade Precoce Central, na PPP não há maturação prematura ou ativação do gerador de pulsos de GnRH hipotalâmico. Os esteroides sexuais produzidos autonomamente exercem seus efeitos diretamente sobre os tecidos-alvo, promovendo o desenvolvimento de características sexuais secundárias. Como consequência direta desta produção hormonal autônoma e independente do controle central, os elevados níveis circulantes de estrogênios ou andrógenos exercem um feedback negativo sobre o eixo HHG. Este mecanismo resulta na supressão da secreção das gonadotrofinas hipofisárias, o hormônio luteinizante (LH) e o hormônio folículo-estimulante (FSH), cujos níveis séricos são tipicamente baixos, suprimidos ou encontram-se em faixa pré-puberal.
Etiologias Tumorais da PPP: Tumores Ovarianos, Testiculares e Adrenais
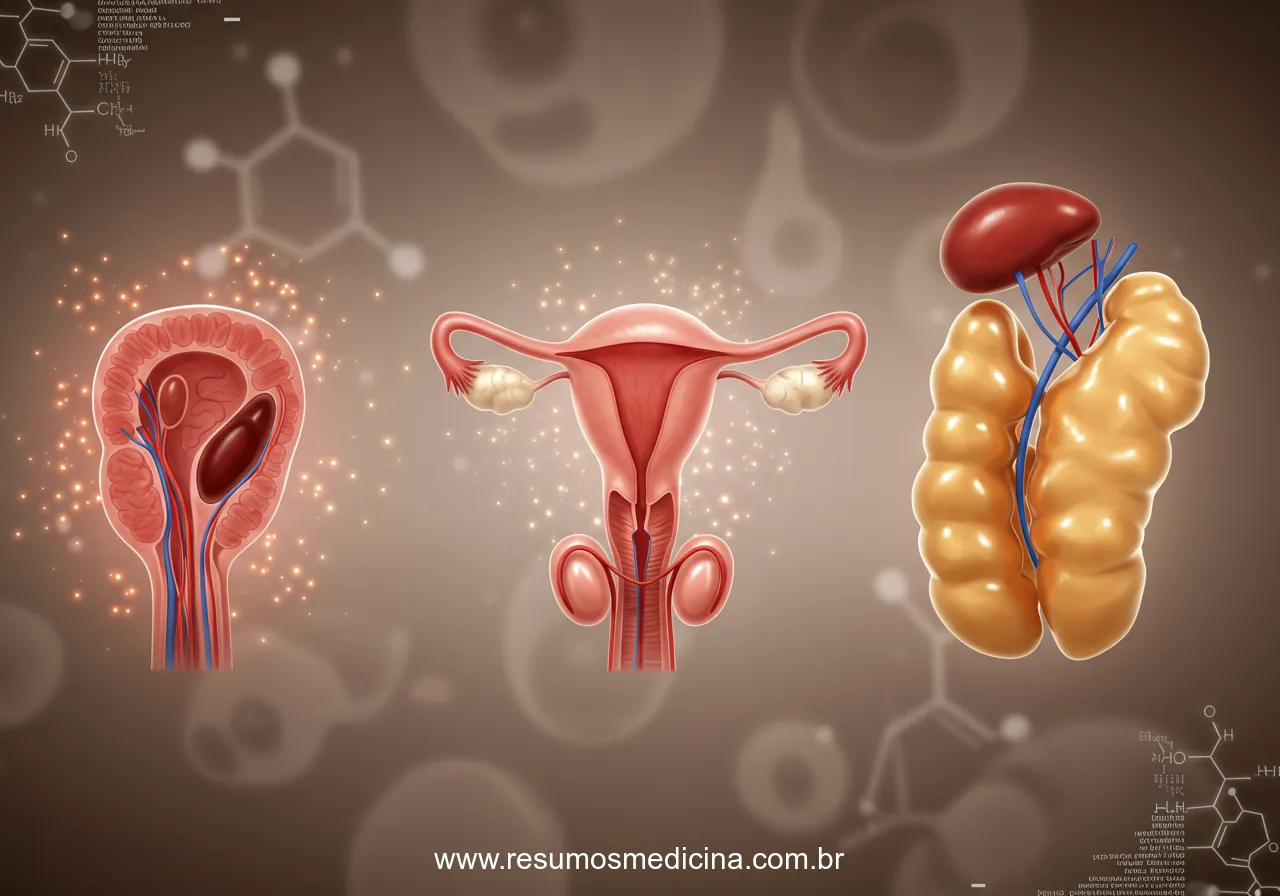
A Puberdade Precoce Periférica (PPP) pode ser desencadeada por neoplasias localizadas nas gônadas (ovários e testículos) ou nas glândulas adrenais. Estes tumores caracterizam-se pela capacidade de produzir e secretar hormônios sexuais (estrogênios e/ou androgênios) de forma autônoma, independente da regulação fisiológica exercida pelo eixo hipotálamo-hipófise-gonadal (HHG). Esta produção hormonal autônoma resulta diretamente no desenvolvimento precoce de características sexuais secundárias.
Tumores Ovarianos
Em meninas, tumores ovarianos ou cistos funcionais representam causas significativas de PPP. Neoplasias como os tumores de células da granulosa e certos cistos ovarianos foliculares são capazes de secretar estrogênio autonomamente. Esta produção estrogênica excessiva e precoce, independente do eixo HHG, resulta no desenvolvimento de características sexuais secundárias femininas, como telarca (desenvolvimento mamário), pubarca (surgimento de pelos pubianos) e, eventualmente, sangramento vaginal semelhante à menarca. Menos frequentemente, tumores ovarianos como os de células de Sertoli-Leydig podem produzir androgênios, levando a sinais de virilização.
Tumores Testiculares
Nos meninos, a causa tumoral mais comum de PPP são os tumores de células de Leydig. Estas neoplasias testiculares secretam testosterona de forma autônoma, induzindo o desenvolvimento precoce de características sexuais secundárias masculinas (virilização), como aumento peniano, surgimento de pelos pubianos e axilares, acne e alteração da voz. Um achado clínico fundamental e distintivo nesses casos é o aumento testicular geralmente unilateral, contrastando com o aumento bilateral simétrico esperado na puberdade precoce central (dependente de GnRH). Embora menos comum, o acometimento pode ser bilateral.
Tumores Adrenais
Tumores do córtex adrenal, que podem ser benignos (adenomas) ou malignos (carcinomas), constituem outra etiologia tumoral da PPP. Frequentemente, estas neoplasias adrenocorticais secretam androgênios autonomamente, como Deidroepiandrosterona (DHEA), Sulfato de Deidroepiandrosterona (DHEA-S), androstenediona e, por vezes, testosterona. O excesso destes androgênios, que podem ser convertidos perifericamente em testosterona mais potente, leva à virilização. Em meninas, manifesta-se clinicamente por pubarca precoce, hirsutismo, acne, engrossamento da voz e clitoromegalia. Em meninos, observa-se aumento do pênis, pelos pubianos, acne e aceleração do crescimento estatural, porém, tipicamente sem aumento significativo do volume testicular, uma vez que a produção hormonal não se origina das gônadas estimuladas pelo eixo HHG (níveis de LH e FSH estão geralmente suprimidos). Embora mais raro, tumores adrenais também podem secretar estrogênios, causando desenvolvimento mamário precoce em meninas ou ginecomastia em meninos.
Hiperplasia Adrenal Congênita (HAC) como Causa de PPP
A Hiperplasia Adrenal Congênita (HAC) constitui um grupo heterogêneo de doenças de herança autossômica recessiva, caracterizadas por defeitos enzimáticos na esteroidogênese adrenal, primariamente afetando a síntese de cortisol. Esta condição representa uma etiologia importante de Puberdade Precoce Periférica (PPP), onde o desenvolvimento de caracteres sexuais secundários é desencadeado pela produção autônoma de esteroides sexuais, independentemente da ativação do eixo hipotálamo-hipófise-gonadal (HHG).
Fisiopatologia e Espectro Clínico
A causa mais prevalente de HAC associada à PPP é a deficiência da enzima 21-hidroxilase. O bloqueio enzimático na via de síntese do cortisol resulta em um acúmulo de precursores esteroides a montante, notavelmente a 17-hidroxiprogesterona (17-OHP). Estes precursores são subsequentemente desviados para a via de síntese de andrógenos adrenais (como androstenediona e DHEA), levando a um estado de hiperandrogenismo.
A HAC abrange um espectro clínico que varia desde formas clássicas graves (com ou sem perda de sal, manifestando-se no período neonatal com virilização da genitália externa em meninas) até formas não clássicas (HAC-NC) ou de início tardio. A HAC-NC, também causada predominantemente pela deficiência de 21-hidroxilase, é uma causa relevante de PPP. Suas manifestações podem incluir pubarca precoce isolada ou associada a outros sinais de hiperandrogenismo, como acne, hirsutismo, aceleração do crescimento e avanço da idade óssea. Em meninas, pode ocorrer virilização, e em mulheres pós-púberes, irregularidades menstruais.
Abordagem Diagnóstica
A confirmação diagnóstica da HAC como causa de PPP depende da avaliação hormonal. A dosagem da 17-OH progesterona sérica é fundamental. Níveis basais acentuadamente elevados são diagnósticos da forma clássica. Na suspeita de HAC-NC, onde os níveis basais podem ser normais ou levemente elevados, o teste de estímulo com ACTH sintético (cosintropina) é crucial: uma resposta exagerada da 17-OHP confirma o diagnóstico da deficiência de 21-hidroxilase, refletindo o acúmulo do precursor devido à reduzida atividade enzimática. A avaliação laboratorial na PPP também inclui a dosagem basal de LH, FSH e outros esteroides sexuais (testosterona, DHEA-S, androstenediona) para auxiliar no diagnóstico diferencial com outras causas de excesso androgênico, como tumores adrenais ou gonadais, onde os níveis de 17-OHP tipicamente não estão elevados ou o perfil androgênico é distinto.
Síndrome de McCune-Albright: Genética e Manifestações
A Síndrome de McCune-Albright (SMA) representa uma causa genética rara de Puberdade Precoce Periférica (PPP). Sua etiopatogenia reside em mutações ativadoras somáticas ocorridas pós-zigoticamente no gene GNAS1. Este gene codifica a subunidade alfa da proteína G estimuladora (Gsα). A mutação resulta na ativação constitutiva da via de sinalização do Adenosina Monofosfato cíclico (AMPc) em diversos tecidos, levando à produção autônoma de hormônios e outras manifestações clínicas independentes do controle fisiológico central, como a produção de esteroides sexuais que caracteriza a PPP nesta condição.
Clinicamente, a SMA é frequentemente definida pela presença de pelo menos duas das três manifestações clássicas que compõem sua tríade característica:
- Manchas café com leite: Lesões hiperpigmentadas cutâneas, tipicamente grandes e com bordas irregulares ou geográficas (“costa do Maine”).
- Displasia fibrosa poliostótica: Substituição do tecido ósseo normal por tecido fibroso em múltiplos ossos, podendo levar a fraturas, deformidades e dor.
- Puberdade Precoce Periférica (PPP): Desenvolvimento puberal independente da ativação do eixo hipotálamo-hipófise-gonadal (HHG), resultante da produção autônoma de esteroides sexuais pelas gônadas afetadas pela mutação GNAS1.
Além da tríade clássica, a ativação constitutiva da via do AMPc pode levar a uma variedade de outras endocrinopatias hiperfuncionantes associadas à SMA. Entre as mais descritas nos conteúdos fornecidos estão o hipertireoidismo, a Síndrome de Cushing (hipercortisolismo autônomo), a acromegalia (excesso de hormônio do crescimento), a hiperprolactinemia e o hiperparatireoidismo. Essas endocrinopatias adicionais reforçam a natureza multissistêmica da SMA, decorrente da disfunção celular induzida pela mutação no gene GNAS1.
Hipotireoidismo Primário Grave: Uma Causa Rara de PPP
O hipotireoidismo primário grave e não tratado representa uma etiologia rara, porém clinicamente relevante, de Puberdade Precoce Periférica (PPP), sendo identificada com maior frequência em pacientes do sexo feminino. Esta condição específica é conhecida na literatura como Síndrome de Van Wyk-Grumbach.
Mecanismo Fisiopatológico Proposto
A base fisiopatológica desta associação reside na resposta endócrina à insuficiência tireoidiana primária. A diminuição da produção de hormônios tireoidianos leva a um aumento compensatório e significativo nos níveis séricos de Hormônio Tireoestimulante (TSH), resultado da hiperestimulação da hipófise.
Acredita-se que, em situações de elevação prolongada e acentuada, o TSH possa exercer uma atividade agonista cruzada, ainda que fraca, sobre os receptores do Hormônio Folículo-Estimulante (FSH), localizados predominantemente nos ovários. Essa interação molecular atípica resulta na estimulação ovariana, com consequente produção autônoma de estrogênio, independente do eixo hipotálamo-hipófise-gonadal. Clinicamente, isso se manifesta pelo desenvolvimento de características sexuais secundárias, como telarca e, ocasionalmente, sangramento vaginal.
Característica Diagnóstica Distintiva: Idade Óssea Atrasada
Um achado clínico fundamental que distingue a PPP associada ao hipotireoidismo de outras causas de puberdade precoce é o estado da maturação esquelética. Contrariamente à aceleração da idade óssea observada na maioria dos quadros de puberdade precoce (especialmente a central), pacientes com hipotireoidismo primário grave tipicamente apresentam uma idade óssea atrasada em relação à sua idade cronológica.
Este retardo na maturação óssea é uma consequência direta da ação insuficiente dos hormônios tireoidianos sobre os condrócitos e osteoblastos, células cruciais para o crescimento e a remodelação do tecido ósseo. Portanto, a presença de sinais de desenvolvimento puberal em conjunto com um atraso na idade óssea constitui um forte indicativo para a investigação de hipotireoidismo primário como causa subjacente.
Diagnóstico da PPP: Avaliação Clínica e Laboratorial
A abordagem diagnóstica da puberdade precoce periférica (PPP) inicia-se com uma avaliação clínica criteriosa, seguida por investigações laboratoriais direcionadas. O objetivo principal é diferenciar a PPP da puberdade precoce central (PPC) e identificar a fonte autônoma de produção de esteroides sexuais, que opera independentemente do eixo hipotálamo-hipófise-gonadal (HHG).
Avaliação Clínica
A investigação clínica compreende uma história detalhada e um exame físico minucioso. É fundamental documentar a sequência e o tempo de aparecimento dos caracteres sexuais secundários. Diferentemente da PPC, onde a sequência dos eventos puberais (telarca, pubarca e menarca em meninas; aumento testicular, pubarca e crescimento genital em meninos) geralmente mimetiza a puberdade fisiológica, na PPP essa progressão pode ser incompleta, não sequencial ou dissociada. A apresentação pode variar dependendo da fonte e do tipo de hormônio sexual produzido autonomamente, podendo manifestar-se, por exemplo, com pubarca isolada ou outras características isoladas.
O exame físico deve focar na identificação de sinais específicos de virilização (como hirsutismo, acne severa, clitoromegalia, engrossamento da voz em meninas) ou feminilização (como ginecomastia em meninos). Em meninos, a avaliação do volume testicular é crucial: na PPP, os testículos geralmente permanecem em tamanho pré-puberal ou apresentam aumento discreto e assimétrico (por exemplo, em tumores testiculares de células de Leydig), contrastando com o aumento bilateral e simétrico observado na PPC, que reflete a estimulação gonadotrófica.
Avaliação Laboratorial
As dosagens hormonais basais são essenciais para a investigação inicial e o diagnóstico diferencial. A avaliação inclui:
- Gonadotrofinas (LH e FSH): Na PPP, os níveis basais de LH e FSH são tipicamente baixos ou suprimidos (em faixa pré-puberal) devido ao feedback negativo exercido pelos elevados níveis de esteroides sexuais produzidos autonomamente. Níveis elevados ou na faixa puberal sugerem ativação do eixo HHG, característico da PPC.
- Esteroides Sexuais (Estradiol e Testosterona): Níveis elevados de estradiol (em meninas) ou testosterona (em meninos), na presença de LH e FSH suprimidos, confirmam a produção periférica e independente do eixo HHG.
- Andrógenos Adrenais (DHEA-S): A dosagem de sulfato de deidroepiandrosterona (DHEA-S) é particularmente útil para investigar a origem adrenal da produção hormonal, especialmente na presença de sinais de virilização ou pubarca precoce. Níveis marcadamente elevados podem indicar tumores adrenais secretores de andrógenos.
- 17-Hidroxiprogesterona (17-OHP): A dosagem basal de 17-OHP é fundamental para o rastreamento da Hiperplasia Adrenal Congênita (HAC), particularmente a forma não clássica por deficiência de 21-hidroxilase, uma causa significativa de PPP. A elevação da 17-OHP basal ou após estímulo com ACTH é diagnóstica.
Teste de Estímulo com GnRH
O teste de estímulo com análogo do GnRH (hormônio liberador de gonadotrofina) é um exame fundamental no diagnóstico diferencial entre PPC e PPP. Este teste avalia a capacidade de resposta da hipófise ao estímulo com GnRH. Na PPP, como a produção de esteroides sexuais é independente da ativação fisiológica do eixo HHG, não se observa uma resposta puberal do LH ao estímulo exógeno com GnRH; os níveis de LH permanecem suprimidos ou em faixa pré-puberal. Esta ausência de resposta puberal do LH confirma a independência gonadotrófica característica da PPP. Em contraste, na PPC, o teste demonstra uma resposta com pico de LH em níveis puberais, indicando a ativação prematura do eixo HHG.
Diagnóstico por Imagem e Investigação Etiológica Adicional
A investigação diagnóstica da puberdade precoce periférica (PPP) é complementada por exames de imagem, essenciais para identificar a fonte autônoma de produção de esteroides sexuais, que pode ser gonadal ou adrenal. A avaliação inicial, após a suspeita clínica e hormonal, frequentemente recorre a estas modalidades para visualizar potenciais lesões.
Avaliação Gonadal por Imagem
A ultrassonografia é a ferramenta primária para a avaliação das gônadas:
- Ultrassonografia Pélvica (Meninas): É utilizada para avaliar os ovários, buscando identificar cistos ovarianos (como cistos foliculares produtores de estrogênio) ou tumores ovarianos (como tumores de células da granulosa ou outros tumores produtores de esteroides) que possam ser a causa da PPP.
- Ultrassonografia Testicular (Meninos): Indicada para avaliar os testículos, especialmente na busca por tumores testiculares produtores de andrógenos, como os tumores de células de Leydig, uma causa comum de PPP em meninos. A ausência de aumento testicular bilateral consistente com puberdade central, associada a sinais de virilização, reforça a necessidade deste exame.
Avaliação Adrenal por Imagem
A avaliação das glândulas adrenais é crucial, pois tumores adrenocorticais (adenomas ou carcinomas) ou hiperplasia adrenal congênita (HAC) são causas potenciais de PPP, devido à produção excessiva de andrógenos ou, mais raramente, estrogênios. Os exames de imagem direcionados às adrenais incluem:
- Ultrassonografia Adrenal: Pode ser utilizada como um método inicial.
- Tomografia Computadorizada (TC) e Ressonância Magnética (RM): São modalidades fundamentais para visualizar as glândulas adrenais e detectar tumores ou hiperplasia. A RM geralmente oferece melhor resolução para caracterizar a natureza da lesão, avaliar sua extensão local e potencial invasão de estruturas adjacentes, sendo particularmente útil na investigação de tumores adrenocorticais.
Esses exames auxiliam na identificação de tumores adrenais secretores de andrógenos ou estrogênios, contribuindo significativamente para o diagnóstico diferencial.
Investigação Etiológica Adicional
Uma investigação etiológica completa é imperativa para o manejo adequado da PPP. Além dos exames de imagem, em casos específicos, a investigação pode se estender à análise genética. Em particular, a pesquisa de mutações germinativas no gene TP53, como a mutação R337H (prevalente em certas regiões do Brasil), deve ser considerada em pacientes com suspeita de tumores adrenocorticais, dado o risco aumentado associado a essa mutação.
Conclusão
Em resumo, a Puberdade Precoce Periférica (PPP) apresenta diversas etiologias, incluindo tumores ovarianos, testiculares e adrenais, Hiperplasia Adrenal Congênita (HAC), Síndrome de McCune-Albright (SMA) e, raramente, Hipotireoidismo Primário Grave. O diagnóstico preciso da PPP requer uma combinação de avaliação clínica detalhada, dosagens hormonais específicas e exames de imagem direcionados para identificar a fonte autônoma de produção de esteroides sexuais. A investigação etiológica completa, incluindo a consideração de testes genéticos em casos selecionados, é essencial para orientar o manejo terapêutico adequado e individualizado para cada paciente.