O equilíbrio ácido-base é um processo fundamental para a homeostase do organismo, consistindo na manutenção da concentração de íons hidrogênio (H+) nos fluidos corporais dentro de uma faixa fisiológica estreita. A medida dessa concentração de H+ é expressa pelo pH, que varia em uma escala de 0 a 14, sendo inversamente proporcional à concentração de H+. No contexto fisiológico humano, o pH sanguíneo arterial é rigorosamente controlado, mantendo-se entre 7,35 e 7,45. Este artigo explora os princípios essenciais desse equilíbrio, sua regulação fisiológica pelos sistemas tampão, pulmões e rins, os mecanismos de compensação e conceitos adicionais relevantes para uma avaliação abrangente.
Definição de pH e Importância do Equilíbrio Ácido-Base
Essa regulação estrita é vital por diversas razões:
- Função Celular e Enzimática: O pH ótimo é crucial para o funcionamento adequado das enzimas e para a manutenção dos processos metabólicos e celulares essenciais.
- Estrutura Proteica: A integridade estrutural e funcional das proteínas depende de um ambiente com pH estável.
- Excitabilidade Celular: O equilíbrio ácido-base influencia diretamente a excitabilidade das membranas nervosas e musculares, bem como a distribuição iônica transmembrana.
- Transporte de Oxigênio: O pH afeta a afinidade da hemoglobina pelo oxigênio, impactando seu transporte e entrega aos tecidos.
Desvios significativos dessa faixa estreita de pH têm consequências graves. Um pH sanguíneo arterial inferior a 7,35 caracteriza a acidemia, enquanto um pH superior a 7,45 define a alcalemia. Essas condições refletem um desequilíbrio subjacente (acidose ou alcalose, respectivamente) e podem comprometer severamente a estabilidade celular, afetar processos metabólicos essenciais, levar a disfunções orgânicas graves e, em casos extremos, resultar em morte.
Portanto, a avaliação do equilíbrio ácido-base, frequentemente realizada por meio da análise de gases arteriais (gasometria arterial), é uma ferramenta diagnóstica essencial na prática clínica. Sua interpretação correta permite não apenas avaliar o estado metabólico e respiratório do paciente, mas também identificar o distúrbio ácido-base primário, verificar a presença e adequação das respostas compensatórias do organismo e detectar a coexistência de distúrbios mistos, orientando assim o manejo terapêutico adequado.
Sistemas Tampão: Componentes e Função
A manutenção do pH sanguíneo dentro da faixa fisiológica é essencial para a homeostase e a função celular adequada. O organismo utiliza sistemas tampão para minimizar as flutuações na concentração de íons hidrogênio (H+), constituindo a primeira linha de defesa contra alterações agudas do equilíbrio ácido-base. Esses sistemas atuam capturando ou liberando H+ conforme necessário.
Os principais sistemas tampão fisiológicos incluem:
- Sistema Bicarbonato/Ácido Carbônico
- Sistema Fosfato
- Proteínas (incluindo Hemoglobina)
- Sistema Amônia
Sistema Bicarbonato/Ácido Carbônico (HCO₃⁻/H₂CO₃)
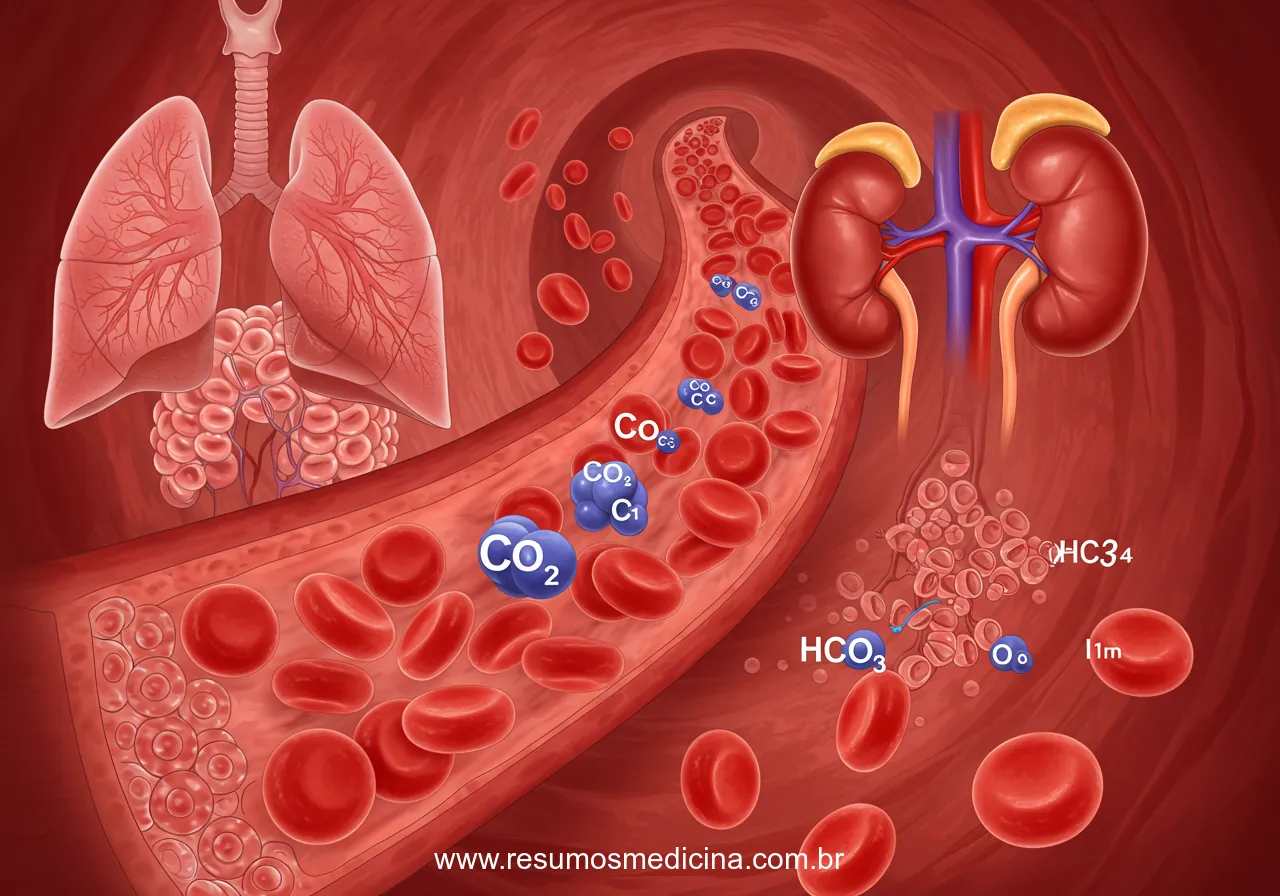
Este é o sistema tampão mais importante no fluido extracelular. Seus componentes são o dióxido de carbono (CO₂), a água (H₂O), o ácido carbônico (H₂CO₃), íons hidrogênio (H⁺) e o íon bicarbonato (HCO₃⁻). O CO₂, produto do metabolismo celular, reage reversivelmente com a água para formar ácido carbônico, reação catalisada pela enzima anidrase carbônica. O ácido carbônico, por sua vez, dissocia-se em H⁺ e HCO₃⁻.
A eficácia deste sistema reside na regulação independente de seus componentes pelos sistemas respiratório e renal. Os pulmões controlam a pressão parcial de dióxido de carbono (pCO₂) através da ventilação alveolar, enquanto os rins regulam a concentração plasmática de bicarbonato (HCO₃⁻) através de mecanismos de reabsorção e excreção. A relação quantitativa entre o pH e os componentes deste sistema tampão é descrita pela equação de Henderson-Hasselbalch, que permite calcular o pH sanguíneo com base nas concentrações de HCO₃⁻ e na pCO₂ (relacionada ao H₂CO₃).
Sistema Fosfato
O sistema tampão fosfato (H₂PO₄⁻/HPO₄²⁻) desempenha um papel significativo no tamponamento dos fluidos intracelulares e na urina, onde sua concentração é maior do que no plasma. Contribui para a excreção renal de ácido.
Sistema de Proteínas
As proteínas, tanto plasmáticas (como a albumina) quanto intracelulares, podem funcionar como tampões devido à presença de grupos ionizáveis em suas cadeias laterais de aminoácidos, que podem aceitar ou doar H⁺. A hemoglobina, presente nos eritrócitos, é uma proteína particularmente importante no tamponamento do sangue venoso, especialmente em relação ao transporte de CO₂.
Sistema Amônia
O sistema amônia (NH₃/NH₄⁺) é um dos principais sistemas tampão. Sua capacidade de aceitar prótons o qualifica como um sistema tampão fisiológico, e sua função se relaciona à excreção renal de H⁺, onde a amônia produzida se combina com H⁺ para formar amônio (NH₄⁺), que é excretado.
A ação conjunta desses sistemas tampão é fundamental para a resposta imediata do organismo às cargas ácidas ou básicas, prevenindo variações drásticas do pH que poderiam comprometer as funções vitais.
Regulação Respiratória: O Papel dos Pulmões e da pCO₂
Os pulmões desempenham um papel fundamental na manutenção do equilíbrio ácido-base, atuando como o principal órgão regulador da pressão parcial de dióxido de carbono (pCO₂) no sangue arterial. A pCO₂, que reflete o componente respiratório do equilíbrio ácido-base, é mantida dentro de uma faixa fisiológica estrita, tipicamente entre 35 e 45 mmHg, através do controle da ventilação pulmonar.
A regulação do pH sanguíneo pelos pulmões é mediada pela eliminação de CO₂, um produto volátil do metabolismo celular. A ventilação alveolar ajusta diretamente os níveis de pCO₂: um aumento na ventilação (hiperventilação) acelera a remoção de CO₂ do sangue, diminuindo a pCO₂ arterial. Essa redução na pCO₂ leva a uma diminuição na concentração de íons hidrogênio (H+) e, consequentemente, a um aumento do pH sanguíneo.
Em contrapartida, uma diminuição na ventilação alveolar (hipoventilação) resulta em acúmulo de CO₂ no sangue, elevando a pCO₂ arterial. Esse aumento na pCO₂ desloca o equilíbrio químico, aumentando a concentração de H+ e provocando uma diminuição do pH sanguíneo.
As alterações primárias na pCO₂ são, por definição, a causa dos distúrbios respiratórios do equilíbrio ácido-base. A acidose respiratória é caracterizada por um aumento primário na pCO₂ (>45 mmHg), resultante da hipoventilação, que leva à acidemia (pH < 7,35). Por outro lado, a alcalose respiratória é definida por uma diminuição primária na pCO₂ (<35 mmHg), causada pela hiperventilação, resultando em alcalemia (pH > 7,45). Portanto, a avaliação da pCO₂ é essencial para identificar a natureza respiratória de um distúrbio ácido-base.
Regulação Renal: Bicarbonato, Excreção de Ácidos e Íons
Os rins desempenham um papel fundamental e insubstituível na manutenção do equilíbrio ácido-base a longo prazo. Atuando de forma mais lenta que o sistema respiratório, a compensação renal pode levar dias para se estabelecer completamente, mas é essencial para a homeostase do pH. Sua função regulatória se manifesta principalmente através de dois mecanismos interligados: a gestão do bicarbonato (HCO₃⁻) e a excreção de ácidos não voláteis.
Regulação do Bicarbonato (HCO₃⁻)
Manter a concentração plasmática de bicarbonato é uma função renal crítica. Em condições normais, os rins reabsorvem virtualmente todo o bicarbonato filtrado pelos glomérulos, um processo que ocorre majoritariamente no túbulo contorcido proximal (TCP). Esta reabsorção não é direta; ela depende da secreção de íons hidrogênio (H⁺) para o lúmen tubular. O H⁺ secretado combina-se com o HCO₃⁻ filtrado para formar ácido carbônico (H₂CO₃), que, catalisado pela anidrase carbônica luminal, dissocia-se em H₂O e CO₂. O CO₂ difunde-se para a célula tubular, onde a anidrase carbônica intracelular catalisa a reação inversa, regenerando H⁺ (que é secretado novamente) e HCO₃⁻, que é então transportado para o interstício e retorna ao sangue.
O estado acidobásico do organismo modula intensamente este processo:
- Acidose (Metabólica ou Respiratória Crônica): Em resposta a um pH reduzido, os rins aumentam a reabsorção de HCO₃⁻ filtrado e também geram novo bicarbonato, contribuindo para elevar o pH plasmático.
- Alcalose (Metabólica ou Respiratória Crônica): Em resposta a um pH elevado, os rins diminuem a reabsorção de HCO₃⁻ no túbulo proximal e aumentam sua excreção líquida na urina, auxiliando na redução do pH plasmático. A eficácia desta excreção na alcalose metabólica pode ser limitada por fatores como depleção de volume ou deficiência de cloreto.
Adicionalmente, a volemia e os níveis de potássio sérico influenciam a reabsorção de bicarbonato. A contração do volume extracelular tipicamente estimula a reabsorção de HCO₃⁻ no TCP, um mecanismo que visa preservar o volume, mas que pode perpetuar uma alcalose metabólica. A hipocalemia também está associada ao aumento da reabsorção de bicarbonato, enquanto a hipercalemia tende a diminuí-la.
Excreção de Ácidos
Além de conservar o bicarbonato, os rins são responsáveis pela excreção da carga diária de ácidos não voláteis (ácidos fixos) produzidos pelo metabolismo, que tipicamente somam cerca de 1 mEq/kg/dia. Essa excreção ocorre principalmente sob duas formas:
- Ácidos Tituláveis: Refere-se principalmente ao fosfato (HPO₄²⁻) que, ao aceitar um H⁺ secretado pelas células tubulares, converte-se em H₂PO₄⁻ e é excretado. Outras substâncias, como a creatinina, também contribuem minoritariamente como ácidos tituláveis.
- Amônio (NH₄⁺): Este é o mecanismo quantitativamente mais importante para a excreção de ácido, especialmente em estados de acidose. As células tubulares renais, particularmente as do túbulo proximal, produzem amoníaco (NH₃) a partir do metabolismo da glutamina. O NH₃, sendo lipossolúvel, difunde-se para o lúmen tubular, onde se combina com H⁺ secretado para formar o íon amônio (NH₄⁺). O NH₄⁺, por ser carregado, fica aprisionado no lúmen e é excretado na urina, geralmente como cloreto de amônio (NH₄Cl). Em condições de acidose, os rins adaptativamente aumentam a produção de amoníaco e, consequentemente, a excreção de NH₄⁺, permitindo a eliminação do excesso de H⁺ sem diminuir excessivamente o pH urinário.
Em resumo, a regulação renal do equilíbrio ácido-base envolve a meticulosa reabsorção e, quando necessário, excreção de bicarbonato, acoplada à excreção de íons hidrogênio na forma de ácidos tituláveis e, crucialmente, amônio, adaptando-se dinamicamente às necessidades do organismo para manter o pH dentro da estreita faixa fisiológica.
Definição e Classificação dos Distúrbios Ácido-Base
Os distúrbios ácido-base representam alterações nos mecanismos fisiológicos que regulam a concentração de íons hidrogênio (H⁺) nos fluidos corporais, impactando diretamente o pH sanguíneo. O equilíbrio ácido-base é essencial para a homeostase, influenciando a função enzimática e a excitabilidade celular, e sua perturbação, refletindo um desequilíbrio entre a produção/ingestão e a eliminação de ácidos ou bases, pode levar a disfunções orgânicas significativas.
É crucial, na análise destes distúrbios, diferenciar os processos fisiopatológicos subjacentes dos estados sanguíneos resultantes:
- Acidose: Refere-se a um processo fisiopatológico que, intrinsecamente, tende a aumentar a concentração de H⁺ no sangue e, consequentemente, a diminuir o pH sanguíneo.
- Alcalose: Refere-se a um processo fisiopatológico que, por sua natureza, tende a diminuir a concentração de H⁺ e, por conseguinte, a aumentar o pH sanguíneo.
- Acidemia: Designa o estado sanguíneo em que o pH arterial está efetivamente abaixo do limite inferior da normalidade (pH < 7,35), indicando um excesso relativo ou absoluto de ácidos.
- Alcalemia: Designa o estado sanguíneo em que o pH arterial se encontra efetivamente acima do limite superior da normalidade (pH > 7,45), indicando um excesso relativo ou absoluto de bases.
A classificação fundamental dos distúrbios ácido-base baseia-se na origem primária da perturbação, categorizando-os em metabólicos ou respiratórios, de acordo com o componente do sistema tampão primariamente afetado:
Distúrbios Metabólicos
Estes distúrbios são caracterizados por uma alteração primária na concentração plasmática de bicarbonato (HCO₃⁻), o principal componente metabólico do equilíbrio ácido-base, cuja regulação depende fundamentalmente da função renal. O intervalo de referência fisiológico para o HCO₃⁻ situa-se entre 22 e 26 mEq/L.
- Acidose Metabólica: É definida por uma redução primária na concentração de HCO₃⁻ (tipicamente < 22 mEq/L), o que leva a uma diminuição do pH sanguíneo (tendência à acidemia).
- Alcalose Metabólica: Caracteriza-se por um aumento primário na concentração de HCO₃⁻ (tipicamente > 26 mEq/L), resultando numa elevação do pH sanguíneo (tendência à alcalemia).
Distúrbios Respiratórios
Estes distúrbios resultam de uma alteração primária na pressão parcial de dióxido de carbono (pCO₂), o componente respiratório do equilíbrio ácido-base, diretamente regulado pela ventilação alveolar pulmonar. O intervalo fisiológico normal para a pCO₂ arterial é de 35 a 45 mmHg.
- Acidose Respiratória: Ocorre devido a um aumento primário da pCO₂ (pCO₂ > 45 mmHg), consequente à hipoventilação alveolar. A retenção de CO₂ aumenta a formação de ácido carbônico, diminuindo o pH (tendência à acidemia).
- Alcalose Respiratória: É definida por uma diminuição primária da pCO₂ (pCO₂ < 35 mmHg), geralmente causada por hiperventilação alveolar. A eliminação excessiva de CO₂ reduz a formação de ácido carbônico, elevando o pH (tendência à alcalemia).
A identificação precisa da natureza primária do distúrbio (metabólica ou respiratória) e a constatação do estado resultante (acidemia ou alcalemia) são etapas essenciais para o diagnóstico e manejo adequados das alterações do equilíbrio ácido-base.
Mecanismos Gerais de Compensação Respiratória e Renal
O organismo possui mecanismos intrínsecos e essenciais para tentar contrabalancear os distúrbios ácido-base e restaurar o pH sanguíneo para a faixa fisiológica. Diante de uma alteração primária, seja ela metabólica ou respiratória, sistemas compensatórios são ativados, envolvendo principalmente os pulmões e os rins.
Compensação Respiratória
A compensação respiratória é uma resposta rápida, ocorrendo em minutos a horas, mediada pelo sistema nervoso central através de quimiorreceptores que detectam alterações no pH e na pressão parcial de dióxido de carbono (pCO₂). Este mecanismo envolve o ajuste da ventilação alveolar para modificar a pCO₂ sanguínea.
- Em distúrbios metabólicos: Na acidose metabólica, onde há uma diminuição primária do bicarbonato (HCO₃⁻), o sistema respiratório responde com hiperventilação, aumentando a eliminação de CO₂, o que reduz a pCO₂ e eleva o pH. Inversamente, na alcalose metabólica, com aumento primário do HCO₃⁻, ocorre hipoventilação para reter CO₂, aumentando a pCO₂ e diminuindo o pH.
A eficácia dessa compensação é influenciada pela capacidade ventilatória do paciente e pela sensibilidade dos quimiorreceptores.
Compensação Renal
A compensação renal é um processo mais lento, levando dias para atingir seu efeito máximo. Os rins atuam regulando a excreção líquida de ácido e a quantidade de bicarbonato (HCO₃⁻) no organismo. Isso é feito através de dois mecanismos principais:
- Regulação da Excreção de H⁺: Em estados de acidose, os rins aumentam a excreção de íons hidrogênio (H⁺), frequentemente na forma de amônio (NH₄⁺) ou ácidos tituláveis. Em alcalose, a excreção de H⁺ é diminuída.
- Regulação do Bicarbonato (HCO₃⁻): Os rins ajustam a reabsorção do HCO₃⁻ filtrado e também podem gerar novo bicarbonato. Na acidose (metabólica ou respiratória crônica), a reabsorção de HCO₃⁻ é aumentada. Na alcalose (metabólica ou respiratória crônica), a reabsorção de HCO₃⁻ é diminuída e sua excreção urinária é aumentada.
É importante salientar que, embora esses mecanismos compensatórios atuem para minimizar as variações do pH e trazê-lo de volta à normalidade, a compensação raramente é completa, ou seja, o pH pode não retornar exatamente à faixa fisiológica ideal apenas com a resposta compensatória.
Compensação Respiratória Específica na Acidose Metabólica (Fórmula de Winter)
A acidose metabólica, definida como uma diminuição primária na concentração de bicarbonato (HCO₃⁻) que resulta em redução do pH sanguíneo, desencadeia uma resposta compensatória pelo sistema respiratório. Este mecanismo busca atenuar a acidemia e restaurar o equilíbrio ácido-base.
Em resposta à diminuição do HCO₃⁻ e à consequente acidemia, quimiorreceptores centrais e periféricos são estimulados, promovendo um aumento da ventilação alveolar. Clinicamente, isso se manifesta como hiperventilação – um aumento na frequência e/ou profundidade respiratória, por vezes evidente como a respiração de Kussmaul (respirações profundas e rápidas). A hiperventilação acelera a eliminação de dióxido de carbono (CO₂), resultando na diminuição da pressão parcial de CO₂ (pCO₂) no sangue arterial. A redução da pCO₂, um componente ácido volátil, ajuda a elevar o pH sanguíneo em direção à faixa normal. É importante notar que esta compensação respiratória inicia-se rapidamente (minutos a horas), mas frequentemente é limitada e pode não normalizar completamente o pH.
Para avaliar quantitativamente se a magnitude da resposta respiratória compensatória é adequada ao grau de acidose metabólica presente, utiliza-se a Fórmula de Winter. Esta fórmula permite estimar a pCO₂ esperada (pCO₂e) com base no nível de bicarbonato sérico medido:
pCO₂ esperada (mmHg) = (1,5 x [HCO₃⁻]) + 8 ± 2
A aplicação desta fórmula é fundamental na interpretação da gasometria arterial em pacientes com acidose metabólica. Compara-se a pCO₂ medida na gasometria com o valor esperado calculado pela fórmula:
- Se a pCO₂ medida estiver dentro da faixa calculada (± 2 mmHg), a compensação respiratória é considerada adequada para o distúrbio metabólico primário.
- Se a pCO₂ medida for significativamente maior que a pCO₂ esperada, sugere-se a presença de uma acidose respiratória concomitante (distúrbio misto), indicando que a resposta ventilatória está inadequada ou há um problema respiratório primário adicional.
- Se a pCO₂ medida for significativamente menor que a pCO₂ esperada, sugere-se a presença de uma alcalose respiratória concomitante (distúrbio misto), indicando uma hiperventilação maior do que a esperada apenas pela compensação metabólica.
Portanto, a Fórmula de Winter é uma ferramenta essencial para determinar a adequação da resposta compensatória fisiológica e para identificar a presença de distúrbios ácido-base mistos, orientando o diagnóstico e manejo clínico.
Conceitos Adicionais: Eletroneutralidade, Base Excess e Influências
Para uma avaliação abrangente do equilíbrio ácido-base, é fundamental compreender conceitos complementares que oferecem insights adicionais sobre o estado fisiológico do paciente. Entre estes, destacam-se o princípio da eletroneutralidade plasmática, o parâmetro Base Excess (BE) e a influência de fatores como volemia, potássio sérico e manejo renal de cloreto.
Princípio da Eletroneutralidade Plasmática
O princípio da eletroneutralidade é um postulado fundamental em fluidos biológicos, incluindo o plasma sanguíneo. Ele estabelece que a soma total das cargas positivas (cátions) deve ser igual à soma total das cargas negativas (ânions), garantindo que a carga elétrica líquida do plasma seja neutra. O principal cátion plasmático é o sódio (Na+), enquanto os principais ânions medidos rotineiramente são o cloreto (Cl-) e o bicarbonato (HCO3-).
A manutenção dessa neutralidade elétrica é essencial para a função celular normal, a estabilidade das reações bioquímicas e o equilíbrio eletroquímico. Qualquer desequilíbrio aparente, ou seja, um desvio da neutralidade, pode indicar alterações significativas no balanço ácido-base ou eletrolítico. A diferença entre a concentração do principal cátion (Na+) e a soma dos principais ânions medidos (Cl- + HCO3-) é conhecida como Ânion Gap, representando a presença de outros ânions não quantificados rotineiramente (como sulfatos, fosfatos e proteínas plasmáticas).
Base Excess (BE)
O Base Excess (BE), ou excesso de base, é um parâmetro calculado que quantifica o componente puramente metabólico dos distúrbios ácido-base. Ele representa a quantidade de ácido ou base forte (em mEq/L) necessária para titular um litro de sangue total a um pH de 7,40, sob uma pCO2 de 40 mmHg e a 37°C.
- Um BE positivo indica um excesso de base, característico da alcalose metabólica.
- Um BE negativo (também chamado de déficit de base) indica um déficit de base, característico da acidose metabólica.
O BE é, portanto, uma ferramenta útil para isolar e avaliar a magnitude da alteração metabólica primária ou compensatória, representando o desvio do bicarbonato em relação ao normal.
Influências Adicionais na Regulação Ácido-Base e Renal
Diversos fatores interagem com os mecanismos renais e sistêmicos de regulação ácido-base:
- Volemia: O estado do volume extracelular influencia diretamente a reabsorção tubular de solutos, incluindo o bicarbonato. A contração de volume (hipovolemia) geralmente estimula a reabsorção de sódio e, consequentemente, de bicarbonato no túbulo proximal, um mecanismo que visa preservar o volume intravascular mas pode perpetuar uma alcalose metabólica. A depleção de volume também pode dificultar a excreção renal de bicarbonato durante a alcalose metabólica.
- Potássio Sérico (K+): Existe uma inter-relação complexa entre o equilíbrio ácido-base e o potássio. A acidemia tende a promover a saída de K+ das células para o espaço extracelular em troca de H+, podendo levar à hipercalemia. Inversamente, a alcalemia favorece a entrada de K+ nas células, podendo causar hipocalemia. Adicionalmente, o nível de potássio influencia a reabsorção renal de bicarbonato: a hipocalemia está associada a um aumento na reabsorção de HCO3-, enquanto a hipercalemia pode diminuí-la. A correção rápida da acidose com bicarbonato pode exacerbar ou causar hipocalemia devido ao influxo celular de K+.
- Reabsorção de Cloreto (Cl-): O manejo renal do cloreto é crucial para o equilíbrio eletrolítico, a manutenção do volume extracelular e a regulação ácido-base. A reabsorção de Cl- ocorre ao longo do néfron por diferentes mecanismos (paracelular no TCP, cotransporte via NKCC2 na alça de Henle espessa, canais e troca aniônica nos segmentos distais). Alterações na volemia e no estado ácido-base afetam diretamente a reabsorção de cloreto. A excreção de ácido na forma de cloreto de amônio (NH₄Cl) é um mecanismo renal chave na acidose. Além disso, a deficiência de cloreto pode limitar a capacidade renal de excretar bicarbonato, contribuindo para a manutenção da alcalose metabólica.
Conclusão
O equilíbrio ácido-base é um sistema complexo e dinâmico, essencial para a manutenção da vida. A compreensão dos princípios que regem este equilíbrio, dos sistemas tampão que atuam para mitigar as variações de pH, do papel crucial dos pulmões e rins na regulação, e dos mecanismos de compensação que se ativam em resposta a distúrbios, é fundamental para a prática clínica. A interpretação correta dos dados da gasometria arterial, o uso de ferramentas como a Fórmula de Winter, e a consideração de fatores como eletroneutralidade, base excess e influências eletrolíticas, permitem uma avaliação abrangente do estado ácido-base do paciente e orientam o manejo terapêutico adequado, visando restaurar e manter a homeostase.