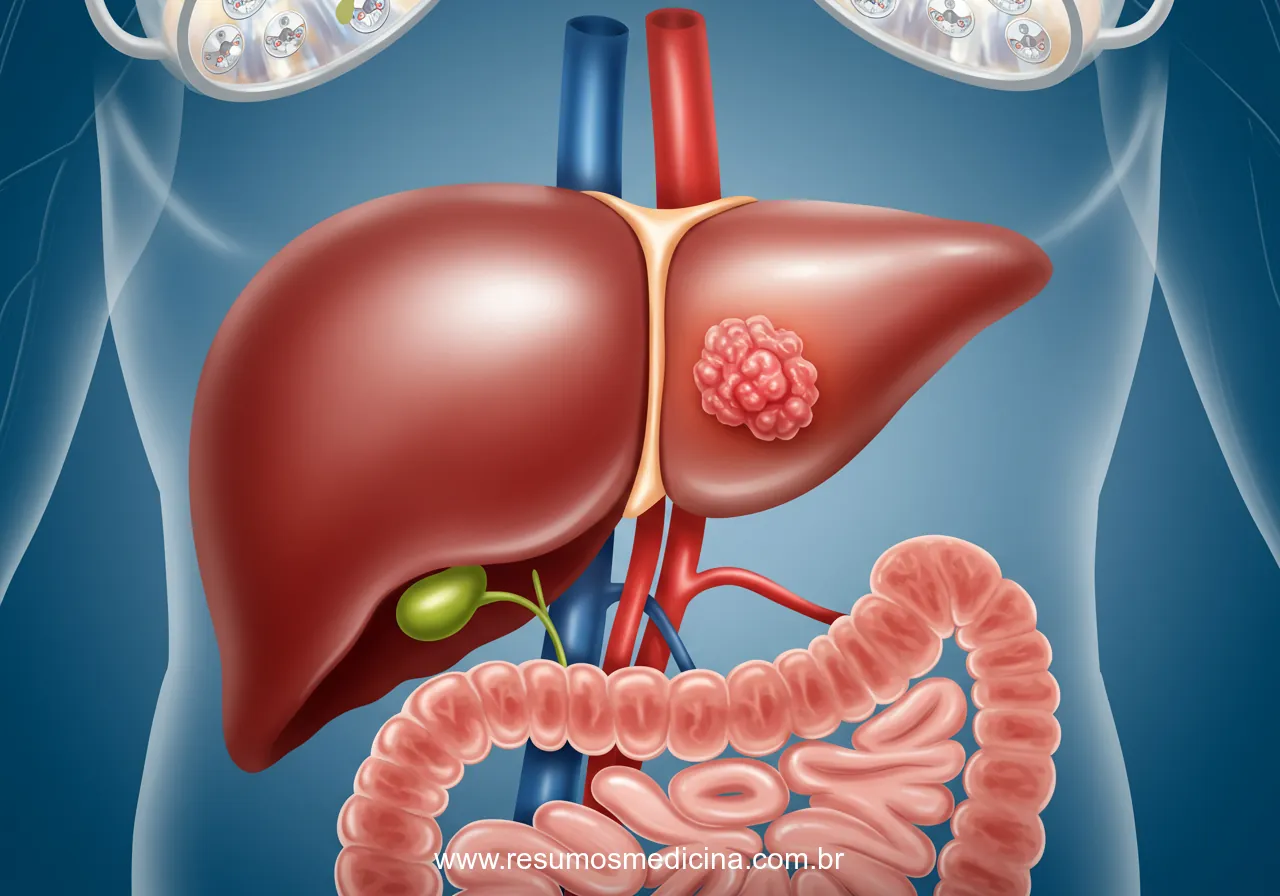
O fígado, devido à sua complexa arquitetura vascular e função metabólica, pode ser acometido por uma ampla gama de lesões nodulares, tanto benignas quanto malignas. A correta identificação e classificação dessas neoplasias são fundamentais para o estadiamento, prognóstico e planejamento terapêutico adequado. As neoplasias hepáticas são categorizadas primariamente em tumores originados no próprio fígado (primários) e aqueles resultantes da disseminação de cânceres de outros órgãos (secundários ou metastáticos).
Classificação Geral das Neoplasias Hepáticas
Uma distinção inicial crucial é entre lesões benignas e malignas. Dentro das malignas, diferencia-se entre as primárias e as secundárias (metastáticas). É importante notar que as metástases hepáticas são as neoplasias malignas mais frequentemente encontradas no fígado, superando a incidência dos tumores primários, incluindo o Carcinoma Hepatocelular (CHC). Essa alta prevalência de metástases deve-se ao rico suprimento sanguíneo do fígado (artéria hepática e veia porta) e sua função como filtro para o sangue sistêmico e portal, facilitando a implantação de células neoplásicas circulantes.
Tumores Hepáticos Benignos
As lesões benignas mais relevantes incluem:
- Hemangioma Hepático: Neoplasia benigna mais comum do fígado, de origem vascular (malformação). Frequentemente é assintomático e diagnosticado incidentalmente por exames de imagem. Na maioria dos casos, não exige tratamento, apenas acompanhamento radiológico periódico.
- Hiperplasia Nodular Focal (HNF): Lesão benigna caracterizada por arquitetura nodular e, classicamente, uma cicatriz fibrosa central. É mais comum em mulheres jovens e adultas, mas, diferentemente do adenoma, não apresenta associação estabelecida com o uso de contraceptivos orais. Geralmente é assintomática e de manejo conservador.
- Adenoma Hepático: Tumor benigno de hepatócitos, mais prevalente em mulheres em idade fértil, associado ao uso de contraceptivos orais estrogênicos e esteroides anabolizantes. Possui risco de complicações como hemorragia e potencial (embora baixo) de transformação maligna, especialmente em lesões maiores que 5 cm. O manejo pode envolver a suspensão de contraceptivos, vigilância por imagem ou ressecção cirúrgica, dependendo do tamanho, subtipo e características clínicas.
Tumores Hepáticos Malignos
Podem ser primários ou secundários:
Malignos Primários
Originam-se das células do próprio fígado:
- Carcinoma Hepatocelular (CHC) ou Hepatocarcinoma: É o tumor maligno primário mais comum do fígado, correspondendo a cerca de 90% desses casos. Sua etiologia está fortemente associada à cirrose hepática de múltiplas causas (hepatites virais B e C, álcool, doença hepática gordurosa não alcoólica [DHGNA], hemocromatose) e à infecção crônica pelo vírus da hepatite B (HBV), que confere risco aumentado mesmo na ausência de cirrose devido ao seu potencial oncogênico direto.
- Colangiocarcinoma: Neoplasia maligna originada do epitélio dos ductos biliares. Pode ser classificado como intra-hepático (dentro do fígado) ou extra-hepático. Fatores de risco incluem colangite esclerosante primária, infestações parasitárias (Opisthorchis, Clonorchis) e doenças biliares crônicas.
- Outros Tumores Primários Raros: Incluem o Angiosarcoma Hepático (tumor vascular agressivo, associado à exposição a toxinas como cloreto de vinila e arsênio) e o Hepatoblastoma (principal tumor hepático maligno na infância).
Malignos Secundários (Metástases)
Representam as neoplasias malignas mais comuns encontradas no parênquima hepático. Resultam da disseminação hematogênica de tumores primários de outros órgãos. Os sítios primários mais frequentes que metastatizam para o fígado incluem cólon e reto, mama, pulmão, pâncreas, estômago e melanoma.
O diagnóstico diferencial preciso entre essas diversas entidades é essencial. A avaliação frequentemente requer uma combinação de história clínica detalhada, exames laboratoriais, marcadores tumorais (como a alfafetoproteína – AFP, relevante no CHC), e métodos de imagem avançados (Ultrassonografia com contraste, Tomografia Computadorizada dinâmica, Ressonância Magnética). Em casos de dúvida diagnóstica, a biópsia hepática percutânea ou por videolaparoscopia para análise histopatológica torna-se imperativa para guiar o tratamento adequado.
Tumores Hepáticos Benignos: Hemangioma, Adenoma e Hiperplasia Nodular Focal (HNF)
Hemangioma Hepático
O hemangioma hepático, sendo a lesão benigna mais prevalente no fígado, demonstra características de imagem que frequentemente possibilitam seu diagnóstico de forma não invasiva. Em exames como ultrassonografia (US), tomografia computadorizada (TC) e ressonância magnética (RM), o padrão típico inclui realce nodular periférico com preenchimento centrípeto progressivo nas fases vasculares tardias. Contudo, formas atípicas existem e devem ser consideradas no diagnóstico diferencial de nódulos hepáticos hipervascularizados. O risco de complicações, como ruptura espontânea, é considerado muito baixo. Devido à sua natureza benigna e baixo risco associado, o manejo padrão é conservador, consistindo em acompanhamento periódico por imagem. A ressecção cirúrgica é raramente necessária, reservada para situações específicas de lesões grandes e sintomáticas.
Adenoma Hepático
O adenoma hepático é uma neoplasia benigna cuja etiologia está frequentemente ligada ao uso de contraceptivos orais contendo estrogênio e esteroides anabolizantes, afetando predominantemente mulheres em idade fértil. Clinicamente, pode ser assintomático ou causar dor abdominal. Esta lesão apresenta riscos clínicos relevantes, notavelmente a possibilidade de hemorragia (ruptura) e um potencial para transformação maligna, risco este que aumenta com o diâmetro da lesão, sendo a ressecção indicada especialmente para adenomas maiores que 5 cm. Os achados de imagem podem ser variáveis, frequentemente exibindo captação de contraste arterial, o que o insere no diagnóstico diferencial de nódulos hepáticos hipervascularizados. O manejo clínico deve ser individualizado, baseado no tamanho do tumor e nos fatores de risco, podendo incluir a interrupção de contraceptivos orais, vigilância por imagem ou ressecção cirúrgica.
Hiperplasia Nodular Focal (HNF)
A Hiperplasia Nodular Focal (HNF) é uma lesão hepática benigna, menos comum que o hemangioma. Morfologicamente, caracteriza-se por ser uma lesão bem definida, frequentemente única, contendo uma cicatriz central fibrosa, na qual se observam vasos sanguíneos anormais. Distintamente do adenoma, a HNF não demonstra associação etiológica estabelecida com o uso de contraceptivos orais. O diagnóstico é fortemente apoiado por características de imagem, incluindo a presença da cicatriz central e um padrão de realce arterial homogêneo. A HNF é um componente importante do diagnóstico diferencial de lesões hipervascularizadas. Dada a sua natureza benigna, ausência de potencial maligno conhecido e por geralmente não causar alterações significativas na função hepática, a abordagem usual é conservadora, não exigindo tratamento específico na maioria dos casos identificados.
Carcinoma Hepatocelular (CHC): Epidemiologia e Fatores de Risco
O Carcinoma Hepatocelular (CHC) ou hepatocarcinoma é a neoplasia maligna primária mais prevalente do fígado. Sua epidemiologia e fatores de risco são cruciais para a compreensão da doença e estratégias de saúde pública.
Epidemiologia do CHC
A incidência do CHC varia significativamente em nível global, com taxas mais elevadas em regiões de alta endemicidade para infecção crônica pelo vírus da hepatite B (HBV), vírus da hepatite C (HCV) e/ou exposição a aflatoxinas. Observa-se uma predominância marcante no sexo masculino (proporção de 3:1 a 8:1) e um aumento da incidência com a idade, concentrando-se majoritariamente entre a sexta e a sétima décadas de vida. Nos países ocidentais, um aumento na incidência tem sido notado, atribuído em parte ao aumento das taxas de infecção por HCV e à melhoria da sobrevida de pacientes cirróticos.
Fatores de Risco Associados
O desenvolvimento do CHC é um processo multifatorial, fortemente associado à presença de doença hepática crônica e inflamação persistente.
- Cirrose Hepática: É o fator de risco isolado mais importante, presente em cerca de 80-98% dos pacientes com CHC. A cirrose, independentemente da etiologia (infecciosa, alcoólica, metabólica, autoimune), induz um ciclo vicioso de lesão, inflamação, necrose e regeneração celular desordenada, criando um microambiente hepático propenso à carcinogênese. As principais etiologias incluem infecções crônicas por HBV e HCV, doença hepática alcoólica, esteato-hepatite não alcoólica (EHNA/NASH), hemocromatose hereditária, deficiência de alfa-1 antitripsina e doença de Wilson.
- Infecção Crônica pelo Vírus da Hepatite B (HBV): Constitui um fator de risco de alta relevância, com capacidade oncogênica direta, podendo induzir CHC mesmo na ausência de cirrose estabelecida. Mecanismos incluem a integração do DNA viral ao genoma do hepatócito, causando instabilidade genômica e alterações em proto-oncogenes e genes supressores de tumor, além da inflamação crônica. Grupos de risco específicos entre portadores de HBV incluem asiáticos (homens > 40 anos, mulheres > 50 anos), afrodescendentes, indivíduos com história familiar de CHC, alta carga viral (>100.000 UI/mL) e HBsAg positivo persistente após tratamento.
- Infecção Crônica pelo Vírus da Hepatite C (HCV): Atua predominantemente através da indução de inflamação crônica, que leva à fibrose progressiva e cirrose. Pacientes com HCV e fibrose avançada (estágios F3 e F4 pela classificação Metavir) apresentam risco substancialmente elevado.
- Aflatoxinas: Micotoxinas produzidas por fungos Aspergillus (especialmente A. flavus e A. parasiticus) que contaminam grãos (amendoim, milho) armazenados em condições inadequadas. A aflatoxina B1 é um potente hepatocarcinógeno, com efeito sinérgico ao HBV, relevante em áreas endêmicas.
- Doença Hepática Gordurosa Não Alcoólica (DHGNA) e Esteato-hepatite Não Alcoólica (EHNA/NASH): Associadas à síndrome metabólica (obesidade, diabetes mellitus tipo 2, dislipidemia), representam causas crescentes de cirrose e CHC globalmente.
- Consumo Excessivo de Álcool: Induz lesão hepática direta, inflamação crônica e progressão para cirrose.
- Doenças Metabólicas Hereditárias: Além das já citadas hemocromatose, deficiência de alfa-1 antitripsina e Doença de Wilson.
- Outros Fatores: Tabagismo e, possivelmente, o uso de esteroides anabolizantes e condições raras como a colangite biliar primária foram implicados. A hepatite autoimune (HAI), se controlada, confere risco menor comparado a outras etiologias de cirrose.
Etiopatogenia
A carcinogênese hepática é um processo complexo. A inflamação crônica persistente, comum a diversos fatores de risco, desempenha um papel central, promovendo estresse oxidativo, dano ao DNA, liberação de citocinas e fatores de crescimento que estimulam a proliferação celular e a angiogênese. No contexto da cirrose, a arquitetura hepática distorcida e o ciclo contínuo de lesão-regeneração aumentam a probabilidade de acúmulo de mutações e alterações epigenéticas em vias de sinalização críticas, resultando em transformação maligna e desenvolvimento do CHC.
Carcinoma Hepatocelular (CHC): Rastreamento e Diagnóstico
A detecção precoce do Carcinoma Hepatocelular (CHC), frequentemente assintomático em seus estágios iniciais, é fundamental para aumentar as chances de tratamento curativo. Para isso, estratégias de rastreamento direcionadas a populações de risco e métodos diagnósticos precisos são essenciais.
Populações de Alto Risco e Protocolo de Rastreamento
O rastreamento do CHC é recomendado para indivíduos com risco significativamente aumentado de desenvolver a neoplasia. A estratégia padrão envolve a realização periódica, a cada 6 meses, de Ultrassonografia (USG) Abdominal, muitas vezes associada à Dosagem de Alfafetoproteína (AFP) Sérica. Os principais grupos de alto risco incluem:
- Pacientes com Cirrose Hepática: Independentemente da etiologia ou do estágio funcional (Child-Pugh), a cirrose é o principal fator predisponente.
- Portadores Crônicos do Vírus da Hepatite B (VHB): Mesmo na ausência de cirrose, devido ao risco oncogênico intrínseco do vírus. A vigilância é particularmente indicada em subgrupos de maior risco, como: indivíduos de ascendência asiática (homens > 40 anos, mulheres > 50 anos), afrodescendentes, aqueles com história familiar de CHC, pacientes com infecção ativa e alta carga viral (e.g., > 100.000 UI/mL), e pacientes HBsAg positivos após tratamento para hepatite B.
- Pacientes com Hepatite C Crônica: Aqueles com fibrose hepática avançada (estágio F3 ou F4 na classificação Metavir) ou cirrose estabelecida.
O objetivo central deste rastreamento semestral é identificar nódulos hepáticos suspeitos em estágios iniciais, aumentando a probabilidade de aplicação de terapias curativas.
Interpretação da Alfafetoproteína (AFP)
A AFP é uma glicoproteína que atua como marcador tumoral no contexto do CHC. Sua utilidade clínica abrange o auxílio no rastreamento, suporte ao diagnóstico e monitoramento terapêutico.
- Limitações: A AFP apresenta sensibilidade e especificidade limitadas. Níveis normais ou discretamente elevados são observados em uma proporção significativa de pacientes com CHC (até 40%), especialmente em tumores iniciais. Adicionalmente, elevações podem ocorrer em outras condições hepáticas (hepatites ativas, cirrose com regeneração ativa, necrose hepatocelular), impactando sua especificidade.
- Níveis Sugestivos: Valores persistentemente elevados, tipicamente acima de 400-500 ng/mL, em pacientes com fatores de risco conhecidos e/ou lesão focal hepática, são altamente sugestivos de CHC. Contudo, a AFP isoladamente não firma o diagnóstico, que deve ser corroborado por achados de imagem e avaliação clínica.
Diagnóstico por Imagem (TC e RM Dinâmicas)
Nódulos hepáticos suspeitos (geralmente > 1 cm) identificados na USG de rastreamento exigem investigação complementar com Tomografia Computadorizada (TC) ou Ressonância Magnética (RM) com estudo dinâmico multifásico após contraste intravenoso (fases arterial, portal e tardia).
- Padrão Vascular Característico do CHC: O diagnóstico radiológico de CHC baseia-se na identificação de um padrão vascular típico:
- Hipervascularização na Fase Arterial (Wash-in): Realce intenso e precoce do contraste, refletindo a neoangiogênese arterial tumoral.
- Lavagem na Fase Portal e/ou Tardia (Washout): Perda rápida do contraste nas fases subsequentes, tornando a lesão hipodensa/hipointensa em relação ao parênquima hepático adjacente, devido à drenagem venosa atípica.
- Diagnóstico Não Invasivo: Em pacientes com fatores de risco estabelecidos (principalmente cirrose), a demonstração deste padrão vascular característico em TC ou RM dinâmicas possui alta especificidade e frequentemente permite o diagnóstico de CHC sem necessidade de confirmação histopatológica.
Papel da Biópsia Hepática
A biópsia hepática para confirmação histológica não é rotineiramente necessária quando os critérios de imagem não invasivos são preenchidos em pacientes de alto risco. Sua indicação é reservada para situações específicas:
- Achados de imagem atípicos, duvidosos ou não conclusivos.
- Diagnóstico em pacientes sem fatores de risco clássicos (sem cirrose ou VHB/VHC crônica).
- Necessidade de caracterização histológica para subtipos específicos (e.g., carcinoma fibrolamelar) ou avaliação do grau de diferenciação tumoral.
- Confirmação histológica pré-requisito para determinados protocolos terapêuticos ou ensaios clínicos.
A biópsia permite a análise microscópica do tecido, confirmando a natureza neoplásica e fornecendo informações sobre a arquitetura e citologia tumoral.
Carcinoma Hepatocelular (CHC): Estadiamento, Classificação e Prognóstico
O estadiamento e a classificação rigorosos do Carcinoma Hepatocelular (CHC) são essenciais para a definição prognóstica e o planejamento terapêutico individualizado. Diversos sistemas foram propostos, sendo o BCLC o mais adotado internacionalmente.
Sistema de Classificação BCLC (Barcelona Clinic Liver Cancer)
O sistema BCLC é considerado o padrão para estadiamento e orientação terapêutica no CHC. Ele integra variáveis relacionadas ao tumor, à função hepática residual e à condição clínica geral do paciente:
- Características Tumorais: Tamanho e número de nódulos.
- Função Hepática: Avaliada pela classificação de Child-Pugh (A, B, C) e/ou escore MELD.
- Estado Geral (Performance Status – PS): Usualmente medido pela escala ECOG (0-4).
- Extensão da Doença: Presença de invasão vascular macroscópica ou metástases extra-hepáticas.
Com base nesses fatores, o BCLC classifica os pacientes em cinco estágios prognósticos e terapêuticos:
- Estágio 0 (Muito Precoce): PS 0, Child-Pugh A, tumor único ≤ 2 cm. Tratamentos curativos (ressecção, ablação, transplante).
- Estágio A (Precoce): PS 0, Child-Pugh A ou B, tumor único ou até 3 nódulos ≤ 3 cm. Tratamentos curativos (ressecção, transplante, ablação).
- Estágio B (Intermediário): PS 0, Child-Pugh A ou B, tumores multinodulares sem invasão vascular ou metástases. Tratamento locorregional (Quimioembolização Transarterial – TACE).
- Estágio C (Avançado): PS 1-2 e/ou invasão vascular ou metástases extra-hepáticas, Child-Pugh A ou B. Terapia sistêmica (ex: Sorafenibe, Lenvatinibe).
- Estágio D (Terminal): PS > 2 ou Child-Pugh C. Cuidados de suporte.
Critérios de Milão para Transplante Hepático
Os Critérios de Milão são um conjunto específico de critérios de classificação utilizados para selecionar pacientes com CHC (geralmente BCLC A) que são candidatos ao transplante hepático, uma modalidade de tratamento curativo. Sua aplicação visa otimizar os resultados pós-transplante e minimizar o risco de recorrência tumoral. Os critérios definem elegibilidade com base em:
- Um único nódulo tumoral com diâmetro ≤ 5 cm.
- OU até três nódulos tumorais, cada um com diâmetro ≤ 3 cm.
Adicionalmente, exige-se a ausência de invasão vascular macroscópica e de metástases extra-hepáticas. Pacientes que se enquadram nestes critérios apresentam taxas de sobrevida pós-transplante significativamente melhores.
Outros Sistemas de Classificação
Outros sistemas prognósticos existem, como o CLIP (Cancer of the Liver Italian Program), que também incorpora características tumorais, função hepática (Child-Pugh) e níveis séricos de alfafetoproteína (AFP) para estratificar o risco.
Fatores Prognósticos no CHC
O prognóstico é influenciado por múltiplos fatores, além do estadiamento BCLC:
- Invasão Vascular: A presença de invasão vascular (macro ou micro) é um marcador de agressividade tumoral e pior prognóstico, associada a maior risco de recorrência e metástases. A trombose da veia porta (TVP) tumoral é especificamente um fator de mau prognóstico que influencia as opções de tratamento.
- Função Hepática (Child-Pugh): A deterioração da função hepática (Child-Pugh B/C) limita as opções terapêuticas e piora significativamente a sobrevida.
- Performance Status (PS): Um PS mais elevado indica pior estado geral e menor tolerância a tratamentos.
- Margens Cirúrgicas (Ressecção): Obtenção de margens livres de neoplasia (R0) na ressecção cirúrgica está associada a menor risco de recorrência local.
- Alfafetoproteína (AFP): Níveis muito elevados de AFP podem se correlacionar com maior carga tumoral e pior prognóstico, embora seu valor prognóstico isolado seja limitado.
- Ruptura Tumoral: A ruptura espontânea do CHC é uma complicação grave que indica doença avançada e está associada a um prognóstico reservado.
Aspectos Histopatológicos, Crescimento e Disseminação
A análise histopatológica, conforme classificações da OMS, fornece informações adicionais sobre o grau de diferenciação tumoral e a presença de invasão microvascular. O CHC pode apresentar padrões de crescimento nodular ou difuso (infiltrativo). A disseminação ocorre principalmente por via hematogênica, com invasão frequente da veia porta e veias hepáticas. Podem ser identificados padrões microarquiteturais como trabecular e acinar (pseudoacinar).
Variante Histopatológica: CHC Fibrolamelar
O Carcinoma Hepatocelular Fibrolamelar é uma variante rara, distinta do CHC clássico. Acomete pacientes mais jovens, tipicamente sem cirrose ou outros fatores de risco hepáticos associados, e frequentemente apresenta níveis normais de AFP. Possui, em geral, um prognóstico mais favorável que o CHC convencional.
Carcinoma Hepatocelular (CHC): Modalidades Terapêuticas
A seleção da modalidade terapêutica para o Carcinoma Hepatocelular (CHC) é um processo complexo, guiado primariamente pelo estadiamento da doença, utilizando-se predominantemente o sistema BCLC (Barcelona Clinic Liver Cancer), e pela avaliação da reserva funcional hepática, comumente pela classificação de Child-Pugh. Uma abordagem multidisciplinar é imperativa para individualizar o tratamento, considerando as características do tumor, a condição hepática subjacente e o estado geral do paciente.
Tratamentos com Intenção Curativa (BCLC 0 e A)
As terapias com potencial curativo são reservadas para pacientes com doença em estágio inicial e função hepática adequada.
- Ressecção Cirúrgica (Hepatectomia): Representa a principal opção curativa para CHC localizado (geralmente único) em pacientes com função hepática preservada (Child-Pugh A), sem hipertensão portal clinicamente significativa ou hiperbilirrubinemia, e ausência de invasão vascular macroscópica ou metástases. A avaliação criteriosa da ressecabilidade e da função hepática remanescente é essencial. O objetivo cirúrgico primordial é a obtenção de margens de ressecção livres de neoplasia (R0). A abordagem pode ser através de ressecções anatômicas (segmentectomias, hepatectomias lobares) ou não anatômicas, sendo as anatômicas preferíveis, frequentemente guiadas por ultrassonografia intraoperatória. Função hepática comprometida (Child-Pugh B/C) e hipertensão portal significativa são contraindicações importantes.
- Transplante Hepático: Oferece a vantagem de tratar tanto o CHC quanto a doença hepática crônica de base (cirrose). É indicado para pacientes com CHC em estágio inicial, mas com função hepática comprometida. A seleção dos candidatos baseia-se em critérios restritivos, como os Critérios de Milão (um nódulo ≤ 5 cm ou até três nódulos ≤ 3 cm cada), para identificar aqueles com menor risco de recorrência tumoral pós-transplante. Pacientes que excedem estes critérios apresentam prognóstico inferior com o transplante.
- Terapias Ablativas Locorregionais: A ablação por radiofrequência (RFA) e a ablação por micro-ondas (MWA) são alternativas curativas eficazes para tumores pequenos (usualmente < 3 cm), correspondendo aos estágios BCLC 0 ou A, em pacientes que não são candidatos à ressecção por comorbidades, localização desfavorável ou função hepática limítrofe. A alcoolização percutânea (PEI) é outra modalidade ablativa descrita, embora menos utilizada atualmente.
Tratamentos Paliativos (BCLC B, C e D)
Para pacientes com doença em estágios intermediário, avançado ou terminal, ou que não são elegíveis para tratamentos curativos, as terapias paliativas visam controlar a progressão tumoral, prolongar a sobrevida e melhorar a qualidade de vida.
- Quimioembolização Transarterial (TACE): Tratamento de escolha para o estágio intermediário (BCLC B), caracterizado por tumores multifocais ou grandes, confinados ao fígado, sem invasão vascular maior ou metástases, em pacientes com boa função hepática (Child-Pugh A ou B). O procedimento envolve a administração seletiva de agentes quimioterápicos seguida pela embolização da artéria nutridora do tumor. A TACE também pode ser empregada como terapia ponte ou ‘downstaging’, buscando reduzir a carga tumoral para tornar pacientes elegíveis aos Critérios de Milão para transplante.
- Terapia Sistêmica: Indicada para o CHC avançado (BCLC C), que inclui pacientes com invasão vascular portal, metástases extra-hepáticas, ou progressão após terapias locorregionais, mantendo uma função hepática relativamente preservada (Child-Pugh A ou B inicial). As opções incluem inibidores de tirosina quinase (TKIs), como Sorafenibe (o primeiro a demonstrar benefício de sobrevida) e Lenvatinibe, além de novas opções como imunoterapia (isolada ou em combinação com outros agentes), que demonstraram eficácia neste cenário.
- Radioterapia: Modalidades como a radioterapia estereotáxica corporal (SBRT) podem ser consideradas em casos selecionados para controle local do tumor ou alívio sintomático, como opção paliativa.
- Cuidados de Suporte: Essenciais em todos os estágios, tornam-se o foco principal no estágio terminal (BCLC D), quando a função hepática é gravemente comprometida (Child-Pugh C) ou o estado geral do paciente é muito debilitado (PS > 2). O objetivo é o controle de sintomas e a manutenção da melhor qualidade de vida possível.
Manejo de Complicações Específicas
- Ruptura Espontânea do CHC: Complicação aguda e grave, associada a tumores geralmente grandes e periféricos. Requer estabilização hemodinâmica imediata e controle do sangramento, prioritariamente por meio de angioembolização transarterial seletiva. A cirurgia de urgência pode ser considerada em casos específicos. O prognóstico após ruptura é significativamente pior, refletindo doença avançada.
- Trombose da Veia Porta (TVP) Tumoral: Achado comum em CHC avançado, representa um fator de mau prognóstico e influencia significativamente as opções terapêuticas, frequentemente limitando abordagens curativas e direcionando para terapias sistêmicas ou paliativas.
- Embolização Arterial Terapêutica para Hemorragia: Procedimento intervencionista que pode ser utilizado para controlar sangramento ativo clinicamente relevante proveniente do tumor, independentemente da ocorrência de ruptura formal.
A decisão terapêutica no CHC deve ser sempre individualizada, considerando a complexidade da doença e as condições do paciente, preferencialmente discutida em um comitê multidisciplinar.
Outras Neoplasias Primárias Malignas do Fígado
Além do Carcinoma Hepatocelular (CHC), outras neoplasias malignas primárias podem originar-se no fígado, sendo importantes no diagnóstico diferencial.
Colangiocarcinoma
Originário das células epiteliais dos ductos biliares, o colangiocarcinoma é classificado anatomicamente em intra-hepático (dentro do parênquima) e extra-hepático. Embora menos comum que o CHC, seus fatores de risco estão associados à inflamação biliar crônica e incluem:
- Colangite Esclerosante Primária (CEP): Uma condição inflamatória crônica dos ductos biliares.
- Infecções Parasitárias Crônicas: Especificamente por trematódeos hepáticos como Opisthorchis viverrini e Clonorchis sinensis, prevalentes em certas regiões geográficas.
- Doenças Biliares Crônicas: Condições que levam à estase e inflamação biliar prolongada.
- Doenças Hereditárias do Fígado: Certas condições genéticas podem predispor ao desenvolvimento de colangiocarcinoma.
Angiosarcoma Hepático
Trata-se de uma neoplasia maligna rara e de comportamento agressivo, derivada das células endoteliais dos vasos sanguíneos hepáticos. Sua etiologia, em alguns casos, está relacionada à exposição ocupacional ou ambiental a produtos químicos específicos, como cloreto de vinil, arsênio e dióxido de tório (Thorotrast). Contudo, uma proporção significativa dos casos é idiopática, ocorrendo sem um fator de risco identificável. O prognóstico do angiosarcoma hepático é geralmente reservado devido à sua agressividade.
Hepatoblastoma
O hepatoblastoma é outra neoplasia maligna primária do fígado, mencionada aqui por sua relevância no diagnóstico diferencial, especialmente em populações pediátricas. Informações detalhadas sobre esta entidade não são o foco principal deste artigo, que se concentra nas neoplasias hepáticas mais prevalentes em adultos.
Metástases Hepáticas: Prevalência, Diagnóstico e Tratamento
As neoplasias hepáticas secundárias, ou metástases, constituem os tumores malignos mais frequentemente encontrados no parênquima hepático, excedendo em prevalência os tumores primários. Esta característica epidemiológica é atribuída à função fisiológica do fígado como um filtro para o sangue portal e sistêmico.
Tumores Primários e Predileção por Metástases Hepáticas
Diversas neoplasias malignas podem originar metástases hepáticas, mas certos tumores primários exibem uma predileção particular por essa disseminação. Os mais comuns incluem:
- Câncer colorretal
- Câncer de mama
- Câncer de pulmão
- Câncer de pâncreas
- Câncer de estômago
- Melanomas
- Tumores do trato urinário
- Tumores carcinoides e neuroendócrinos (podem gerar metástases hipervascularizadas)
Diagnóstico de Metástases Hepáticas
Apresentação Radiológica
A avaliação por métodos de imagem é crucial para a detecção e caracterização das metástases hepáticas.
- Tomografia Computadorizada (TC) com Contraste Dinâmico: As metástases tipicamente manifestam-se como múltiplos nódulos de tamanhos variados, distribuídos pelo parênquima. Frequentemente são hipodensas em relação ao fígado normal. O padrão de realce após administração de contraste intravenoso é variável (heterogêneo, periférico em anel, ou ausente), dependendo da vascularização do tumor primário. A análise nas fases arterial, portal e tardia é essencial. Metástases de tumores hipervasculares (ex: carcinoma de células renais, melanoma, tumores neuroendócrinos) podem apresentar realce arterial significativo.
- Ultrassonografia (USG): A aparência ultrassonográfica das metástases é diversa, podendo ser hipoecóicas, hiperecóicas ou de ecogenicidade mista. A presença de um halo hipoecóico perilesional pode ser sugestiva, mas não é um sinal específico.
- Ressonância Magnética (RM) com Contraste Dinâmico: Frequentemente considerada a modalidade com maior sensibilidade, especialmente para a detecção de lesões menores. Permite caracterização detalhada dos padrões de realce.
Métodos Diagnósticos e Diferenciais
A confirmação diagnóstica integra achados de imagem e, em casos selecionados, histopatologia.
- Biópsia Hepática Guiada por Imagem: Reservada para situações em que os exames de imagem são inconclusivos ou quando a identificação da origem primária do tumor é necessária para orientar a terapia sistêmica.
- Diagnóstico Diferencial: É fundamental a distinção entre metástases e outras lesões hepáticas. Ao contrário do CHC, que frequentemente se apresenta como lesão única ou oligo-nodular em fígado cirrótico, as metástases são caracteristicamente múltiplas e bilaterais. Outras entidades a considerar incluem abscessos hepáticos, cistos complexos ou atípicos, hemangiomas atípicos e linfoma hepático.
Tratamento das Metástases Hepáticas
A abordagem terapêutica é complexa, individualizada e requer decisão multidisciplinar. Depende fundamentalmente do sítio primário do tumor, do estágio da doença primária, da extensão da doença metastática (hepática e extra-hepática) e das condições clínicas do paciente.
Ressecção Cirúrgica
A ressecção cirúrgica oferece o maior potencial curativo para pacientes com metástases hepáticas, sendo mais estabelecida para metástases de origem colorretal (MHCCR). Os critérios essenciais para indicação cirúrgica são:
- Possibilidade técnica de ressecção completa de todas as lesões metastáticas com margens cirúrgicas microscopicamente livres (ressecção R0).
- Preservação de um volume de parênquima hepático funcional remanescente suficiente (geralmente >30% do volume total estimado).
- Doença primária controlada ou passível de controle.
- Ausência de doença extra-hepática significativa e irressecável.
- Condições clínicas adequadas do paciente.
Contraindicações incluem impossibilidade técnica de obter margens R0, insuficiência hepática preexistente significativa e doença extra-hepática disseminada e incontrolável.
Outras Abordagens Terapêuticas
Para pacientes com doença irressecável, ou como parte de estratégias combinadas:
- Quimioterapia Sistêmica: Pode ser administrada como terapia neoadjuvante (pré-operatória), adjuvante (pós-operatória) ou paliativa. A quimioterapia de conversão tem o objetivo específico de reduzir o volume tumoral de metástases inicialmente irressecáveis, tornando-as passíveis de ressecção cirúrgica subsequente.
- Terapias-Alvo: Direcionadas a alterações moleculares específicas do tumor primário.
- Terapias Loco-Regionais:
- Ablação por Radiofrequência (RFA) ou Micro-ondas (MWA): Para lesões menores, isoladas ou como complemento à cirurgia.
- Embolização / Quimioembolização (TACE): Geralmente paliativas para controle tumoral.
- Embolização da Veia Porta Pré-operatória: Técnica utilizada antes de hepatectomias extensas para induzir hipertrofia compensatória do futuro fígado remanescente, minimizando o risco de insuficiência hepática pós-operatória.
- Radioterapia Estereotáxica Corporal (SBRT): Opção de tratamento localizado para metástases selecionadas.
Para metástases hepáticas irressecáveis, particularmente de câncer colorretal, o tratamento multimodal frequentemente envolve quimioterapia sistêmica combinada ou não com terapias-alvo e, eventualmente, abordagens loco-regionais.
Prognóstico
A presença de metástases hepáticas geralmente indica doença sistêmica avançada e impacta negativamente o prognóstico. A sobrevida varia consideravelmente dependendo de fatores como o tipo de tumor primário, a carga tumoral hepática (número e tamanho das metástases), a presença e extensão da doença extra-hepática, o intervalo livre de doença desde o tumor primário, a resposta às terapias e o estado geral (Performance Status) do paciente. Para metástases hepáticas de câncer colorretal não tratadas, o prognóstico é particularmente reservado, com sobrevida média estimada entre 6 e 12 meses. A ressecção cirúrgica em candidatos apropriados pode aumentar significativamente a sobrevida a longo prazo.
Princípios do Tratamento Cirúrgico e Abordagens Adicionais
A ressecção cirúrgica constitui uma das principais modalidades terapêuticas com potencial curativo para neoplasias hepáticas selecionadas, tanto primárias quanto metastáticas, desde que a doença esteja localizada e a reserva funcional hepática do paciente seja adequada. O princípio fundamental da cirurgia hepática oncológica é a remoção completa do tumor, visando obter margens cirúrgicas microscopicamente livres (ressecção R0), com a concomitante preservação de um volume de parênquima hepático funcional suficiente para evitar insuficiência hepática pós-operatória.
Avaliação Pré-operatória e Determinação da Ressecabilidade
A indicação cirúrgica exige uma avaliação pré-operatória detalhada e multidisciplinar. A quantificação da reserva funcional hepática, utilizando parâmetros clínicos e laboratoriais consolidados em escores como o Child-Pugh, é um passo crítico. A análise criteriosa das características tumorais (tamanho, número, localização, relação com estruturas vasculares e biliares) e a exclusão de doença extra-hepática irressecável são igualmente essenciais para definir a viabilidade técnica e oncológica da ressecção. A determinação da ressecabilidade baseia-se na capacidade de remover todo o tumor com margens livres, mantendo um Futuro Remanescente Hepático (FRH) viável.
Considerações Técnicas: Ressecção Anatômica e Ultrassom Intraoperatório
As hepatectomias podem ser realizadas seguindo abordagens anatômicas ou não anatômicas:
- Ressecções Anatômicas: Incluem segmentectomias, secionectomias ou lobectomias, baseadas na segmentação hepática de Couinaud. Estas ressecções respeitam os planos vasculares e biliares, sendo geralmente preferíveis por permitirem um melhor controle do sangramento intraoperatório e por estarem potencialmente associadas a menores taxas de recorrência local, ao removerem a unidade segmentar ou setorial que contém o tumor.
- Ressecções Não Anatômicas (em Cunha): Não seguem estritamente os planos segmentares e são frequentemente utilizadas para lesões periféricas e menores.
O Ultrassom Intraoperatório (USIO) é uma ferramenta indispensável durante a cirurgia hepática. Ele permite a localização precisa de lesões não palpáveis, a avaliação detalhada da relação do tumor com os pedículos vasculares e ductos biliares, a identificação de lesões adicionais não detectadas nos exames pré-operatórios e auxilia na demarcação dos planos de ressecção, contribuindo significativamente para a segurança e a radicalidade oncológica do procedimento.
Estratégias para Otimizar o Remanescente Hepático: Embolização Portal Pré-operatória
Em situações onde a ressecção planejada é extensa e o volume do Futuro Remanescente Hepático (FRH) estimado é considerado insuficiente (inferior a 25-30% do volume total em fígados normais, ou limiares maiores em fígados doentes), existe um risco elevado de insuficiência hepática pós-operatória (IHPO). Para mitigar esse risco, a Embolização Portal Pré-operatória (EPP) pode ser empregada. Este procedimento radiológico intervencionista consiste na oclusão seletiva do ramo portal que supre o lobo ou segmentos hepáticos a serem ressecados. O redirecionamento do fluxo sanguíneo portal para o parênquima contralateral induz uma hipertrofia compensatória do FRH. Após um período (geralmente 4-8 semanas), o aumento volumétrico do FRH é avaliado por imagem, e se considerado adequado, a hepatectomia pode ser realizada com maior segurança.
A combinação de uma criteriosa avaliação pré-operatória, planejamento detalhado, uso de técnicas cirúrgicas precisas guiadas por USIO e a aplicação estratégica de abordagens como a EPP são fundamentais para maximizar a segurança e a eficácia do tratamento cirúrgico das neoplasias hepáticas.