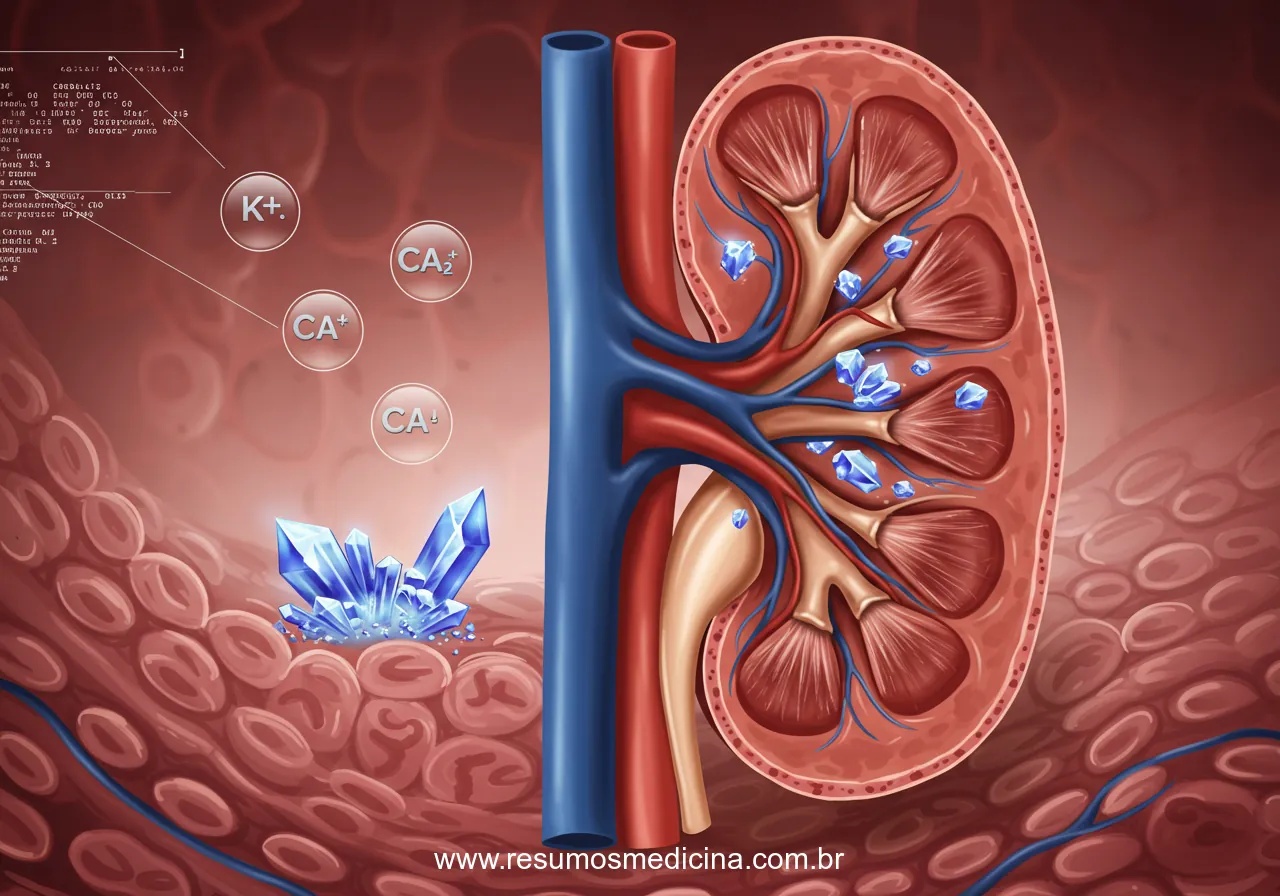
A Síndrome de Lise Tumoral (SLT) é uma emergência oncológica caracterizada por um conjunto de distúrbios metabólicos que surgem após a destruição rápida e maciça de células tumorais, espontaneamente ou em resposta à terapia antineoplásica. A liberação abrupta do conteúdo intracelular no espaço extracelular desencadeia alterações eletrolíticas e metabólicas que podem levar a um espectro de manifestações clínicas, variando desde achados laboratoriais assintomáticos até complicações orgânicas graves e potencialmente letais.
Introdução às Manifestações Clínicas da Síndrome de Lise Tumoral (SLT)
A apresentação clínica da SLT é intrinsecamente heterogênea, dependendo diretamente da intensidade e da velocidade de instalação dos distúrbios metabólicos – notadamente hipercalemia, hiperfosfatemia (com consequente hipocalcemia) e hiperuricemia – bem como da capacidade fisiológica do paciente em excretar e metabolizar os produtos liberados e da presença de comorbidades, especialmente disfunção renal prévia. As consequências clínicas primárias afetam principalmente os rins, o coração e o sistema nervoso central, decorrentes diretamente dessas alterações bioquímicas.
Classificação e Critérios Diagnósticos
A SLT é classificada com base na presença de alterações laboratoriais e manifestações clínicas, conforme os critérios de Cairo-Bishop:
- SLT Laboratorial: Definida pela presença documentada de duas ou more das seguintes alterações metabólicas ocorrendo dentro de três dias antes ou até sete dias após o início da terapia citotóxica, na ausência de sintomas clínicos ou disfunção orgânica atribuível:
- Ácido Úrico: ≥ 8 mg/dL ou aumento de 25% em relação ao valor basal.
- Potássio: ≥ 6.0 mEq/L ou aumento de 25% em relação ao valor basal.
- Fósforo: ≥ 4.5 mg/dL (ou ≥ 6.5 mg/dL em crianças) ou aumento de 25% em relação ao valor basal.
- Cálcio (total corrigido ou ionizado): ≤ 7 mg/dL ou diminuição de 25% em relação ao valor basal.
- SLT Clínica: Caracterizada pela presença de SLT Laboratorial concomitante com pelo menos uma das seguintes manifestações clínicas graves, não diretamente atribuível a agentes terapêuticos:
- Lesão Renal Aguda (LRA): Aumento da creatinina sérica ≥ 0.3 mg/dL ou aumento ≥ 1.5 vezes o valor basal, ou oligúria.
- Arritmias Cardíacas: Incluindo arritmias clinicamente significativas ou morte súbita.
- Convulsões: Atividade convulsiva generalizada ou focal.
Adicionalmente às manifestações que definem a SLT Clínica, é comum os pacientes apresentarem sinais e sintomas como náuseas, vômitos, diarreia, anorexia, letargia, fadiga, cãibras musculares, tetania, espasmos, edema e sinais de sobrecarga de volume. A compreensão desta classificação e das potenciais manifestações é fundamental para o diagnóstico precoce e manejo adequado desta síndrome.
Hipercalemia na SLT: Impacto Neuromuscular e Risco Cardíaco
A hipercalemia, resultante da liberação massiva de potássio intracelular durante a lise das células tumorais, representa uma das complicações mais críticas da Síndrome de Lise Tumoral (SLT). O aumento da concentração de potássio sérico impacta diretamente o potencial de membrana das células excitáveis, gerando repercussões significativas nos sistemas neuromuscular e cardíaco.
Efeitos Neuromusculares
No sistema neuromuscular, a hipercalemia pode manifestar-se clinicamente com fraqueza muscular progressiva. Em cenários de maior gravidade, esta condição pode evoluir para uma paralisia flácida, comprometendo a função motora.
Impacto Cardíaco e Alterações Eletrocardiográficas (ECG)
O efeito da hipercalemia sobre o miocárdio é particularmente preocupante devido ao risco iminente de arritmias potencialmente letais. O aumento do potássio extracelular altera o potencial de repouso da membrana das células cardíacas, comprometendo a excitabilidade e a condução dos impulsos elétricos.
As manifestações eletrocardiográficas tipicamente progridem de forma sequencial à medida que os níveis séricos de potássio aumentam:
- Ondas T apiculadas: Altas e estreitas, são frequentemente o primeiro sinal.
- Achatamento da onda P: A onda P pode se tornar menos visível com a progressão da hipercalemia.
- Prolongamento do intervalo PR: Indica um atraso na condução do estímulo dos átrios para os ventrículos.
- Alargamento do complexo QRS: Reflete uma condução intraventricular mais lenta.
- Padrão sinusoidal: Em casos de hipercalemia severa, a fusão do complexo QRS alargado com a onda T gera este padrão ominoso, que frequentemente precede a parada cardíaca.
Risco de Arritmias Graves
As alterações eletrofisiológicas descritas elevam significativamente o risco de desenvolvimento de arritmias cardíacas graves, que podem culminar em parada cardíaca e morte súbita. As principais arritmias associadas à hipercalemia na SLT incluem:
- Taquicardia ventricular (TV).
- Fibrilação ventricular (FV).
- Assistolia.
A severidade dos efeitos cardíacos está relacionada não apenas ao nível absoluto de potássio sérico, mas também à velocidade com que a hipercalemia se instala.
Hiperfosfatemia e Hipocalcemia Secundária: Mecanismos e Consequências Clínicas
A lise de células tumorais na Síndrome de Lise Tumoral (SLT) provoca a liberação de grandes quantidades de fosfato intracelular no plasma, resultando em hiperfosfatemia. Este aumento abrupto nos níveis de fosfato sérico desencadeia diretamente a hipocalcemia, uma complicação frequente e clinicamente relevante da SLT.
O mecanismo fundamental para a hipocalcemia reside na lei de ação das massas: o excesso de íons fosfato liga-se avidamente ao cálcio sérico, formando complexos de fosfato de cálcio. Estes complexos são pouco solúveis em pH fisiológico, levando à sua precipitação. Este processo químico sequestra o cálcio circulante, diminuindo a concentração de cálcio ionizado livre – a fração biologicamente ativa – e, simultaneamente, favorece a deposição destes cristais em diversos tecidos, notadamente nos rins (nefrocalcinose), mas potencialmente em outros locais.
Manifestações Clínicas da Hipocalcemia
A redução do cálcio ionizado sérico aumenta a excitabilidade neuromuscular e pode afetar a função neurológica central. A intensidade das manifestações clínicas está associada à magnitude e à velocidade de instalação da hipocalcemia. Os achados clínicos característicos incluem:
- Irritabilidade Neuromuscular: Tetania (espasmos musculares involuntários), cãibras, espasmo carpopedal, e sinais clínicos específicos como o sinal de Chvostek (contração muscular facial à percussão do nervo facial) e o sinal de Trousseau (espasmo carpal induzido por isquemia do braço).
- Manifestações Neurológicas Centrais: Em casos mais severos, podem ocorrer convulsões generalizadas ou focais, além de alterações do estado mental como confusão, desorientação e irritabilidade.
Impacto Cardíaco da Hipocalcemia
O cálcio ionizado é essencial para a função elétrica e contrátil do miocárdio. A hipocalcemia impacta a eletrofisiologia cardíaca, manifestando-se no eletrocardiograma principalmente pelo prolongamento do intervalo QT. Este prolongamento, decorrente do atraso na fase de repolarização ventricular, eleva o risco de arritmias ventriculares polimórficas graves, como a Torsades de Pointes, que pode progredir para fibrilação ventricular. A hipocalcemia severa também pode comprometer a contratilidade miocárdica.
Deposição de Fosfato de Cálcio e Lesão Renal
A precipitação de cristais de fosfato de cálcio, consequência direta da hiperfosfatemia e da subsequente quelação do cálcio, é um mecanismo fisiopatológico crucial na SLT. A deposição destes cristais, especialmente nos túbulos renais e no interstício (nefrocalcinose), causa obstrução tubular e contribui significativamente para o desenvolvimento ou exacerbação da lesão renal aguda (LRA). Este dano renal soma-se aos efeitos da hiperuricemia e de outros fatores potencialmente presentes na SLT, como a vasoconstrição renal.
Hiperuricemia e Nefropatia por Ácido Úrico: Um Fator Chave na Lesão Renal
A hiperuricemia constitui uma alteração metabólica fundamental na Síndrome de Lise Tumoral (SLT), decorrente da rápida degradação de ácidos nucleicos (particularmente purinas) liberados em grandes volumes pelas células tumorais em lise. O metabolismo subsequente dessas purinas sobrecarrega a via de produção de ácido úrico, resultando em níveis séricos e urinários acentuadamente elevados.
Mecanismos Fisiopatológicos da Nefropatia por Ácido Úrico
A elevação do ácido úrico sérico é um indutor primário de Lesão Renal Aguda (LRA) na SLT, através da denominada nefropatia por ácido úrico. A patogênese envolve a precipitação de ácido úrico sob a forma de cristais no lúmen dos túbulos renais. Diversos fatores contribuem para este processo:
- Baixa Solubilidade do Ácido Úrico: O ácido úrico é intrinsecamente pouco solúvel, e sua solubilidade diminui drasticamente em meio ácido, condição frequentemente encontrada no ambiente tubular renal.
- Obstrução Tubular Mecânica: A formação e agregação dos cristais de ácido úrico causam obstrução física ao fluxo de urina nos túbulos e ductos coletores, levando à redução da taxa de filtração glomerular.
- Lesão e Inflamação Tubular: Além da obstrução, altas concentrações de ácido úrico no filtrado glomerular podem induzir uma resposta inflamatória no interstício renal e causar dano direto às células epiteliais tubulares.
A nefropatia por ácido úrico representa, assim, um mecanismo central na etiologia da LRA associada à SLT, contribuindo significativamente para a disfunção renal observada.
Estratégias de Prevenção e Manejo da Hiperuricemia
A abordagem da hiperuricemia é um pilar na prevenção e tratamento da SLT e suas complicações renais. As estratégias incluem:
- Hidratação Intravenosa Vigorosa: Essencial para aumentar o débito urinário, diluir a concentração de ácido úrico nos túbulos renais e facilitar sua excreção, minimizando o risco de cristalização.
- Agentes Hipouricemiantes:
- Alopurinol: Atua como inibidor da enzima xantina oxidase, bloqueando a etapa final da síntese de ácido úrico a partir das purinas. Indicado primariamente para profilaxia.
- Rasburicase: Enzima urato oxidase recombinante que catalisa a oxidação do ácido úrico já formado em alantoína, um composto cinco a dez vezes mais solúvel. É particularmente eficaz na redução rápida de níveis elevados de ácido úrico e é preferível em pacientes considerados de alto risco para SLT, com hiperuricemia já estabelecida ou com insuficiência renal preexistente.
Papel Controverso da Alcalinização Urinária
A alcalinização da urina, tipicamente com bicarbonato de sódio intravenoso ou acetazolamida, tem sido proposta com o objetivo de aumentar a solubilidade do ácido úrico no filtrado tubular e reduzir o risco de precipitação. No entanto, a eficácia e a segurança desta abordagem são controversas. A elevação do pH urinário, embora favoreça a solubilidade do ácido úrico, simultaneamente reduz drasticamente a solubilidade do fosfato de cálcio. Isso pode aumentar o risco de precipitação de cristais de fosfato de cálcio nos túbulos (nefrocalcinose), potencialmente exacerbando a LRA e a hipocalcemia. Adicionalmente, a administração de bicarbonato pode levar à alcalose metabólica. Diante desses riscos, a decisão de utilizar a alcalinização urinária deve ser cuidadosamente ponderada e individualizada para cada paciente.
Lesão Renal Aguda (LRA) na SLT: Uma Complicação Multifatorial
A lesão renal aguda (LRA) constitui uma das consequências clínicas mais graves e frequentes da Síndrome de Lise Tumoral (SLT). Sua etiopatogenia é intrinsecamente multifatorial, decorrendo da sobrecarga renal aguda por metabólitos e eletrólitos liberados massivamente durante a lise celular, excedendo a capacidade homeostática e excretora dos rins.
Principais Mecanismos Patofisiológicos da LRA na SLT
A disfunção renal na SLT resulta da interação sinérgica de múltiplos fatores:
- Nefropatia por Ácido Úrico: A hiperuricemia, previamente detalhada, contribui significativamente para a LRA através da precipitação de cristais de ácido úrico nos túbulos renais. Este processo leva à obstrução tubular e a uma resposta inflamatória local, comprometendo a função renal.
- Precipitação de Fosfato de Cálcio: A hiperfosfatemia, também abordada anteriormente, induz a formação e deposição de cristais de fosfato de cálcio nos túbulos renais e interstício (nefrocalcinose). Similarmente à nefropatia por urato, essa precipitação causa obstrução e colabora para a LRA. A hipocalcemia secundária é uma consequência associada.
- Vasoconstrição Renal: Evidências sugerem que fatores liberados durante a lise celular, ou mecanismos inflamatórios secundários, podem induzir vasoconstrição intrarrenal. A redução resultante do fluxo sanguíneo renal e da taxa de filtração glomerular é um componente adicional na patogênese da LRA. Os mediadores exatos e a potencial contribuição da própria hiperuricemia para este fenômeno ainda não estão completamente elucidados.
Fatores Agravantes
Certas condições podem exacerbar o risco e a severidade da LRA no contexto da SLT:
- Hipovolemia/Desidratação: Estados de depleção de volume, comuns devido a sintomas gastrointestinais ou baixa ingesta, diminuem o fluxo urinário e aumentam a concentração de solutos intratubulares, facilitando a precipitação de cristais de ácido úrico e fosfato de cálcio.
- Nefrotoxicidade de Quimioterápicos: A toxicidade renal intrínseca de alguns agentes quimioterápicos pode adicionar um insulto direto ao rim, agravando a lesão induzida pelos distúrbios metabólicos da SLT.
Manifestações Clínicas e Laboratoriais da LRA
Clinicamente, a LRA na SLT se manifesta por uma deterioração da função renal, caracterizada por:
- Redução do débito urinário (oligúria) ou sua ausência (anúria).
- Elevação progressiva dos níveis séricos de escórias nitrogenadas (ureia e creatinina).
- Desenvolvimento de sobrecarga de volume, manifestada como edema periférico ou, em casos mais graves, edema pulmonar.
- Acidose metabólica, frequentemente com ânion-gap aumentado, reflexo da incapacidade renal em excretar a carga ácida endógena e do acúmulo de fosfatos.
A severidade da LRA é variável, podendo progredir até a necessidade de terapia renal substitutiva, como a diálise, para manejo das alterações hidroeletrolíticas, acidobásicas e da uremia.
Arritmias Cardíacas na SLT: A Interação Perigosa dos Distúrbios Eletrolíticos
As arritmias cardíacas constituem uma das complicações mais graves e potencialmente fatais da Síndrome de Lise Tumoral (SLT), emergindo como consequência direta dos severos distúrbios eletrolíticos inerentes a esta condição, nomeadamente a hipercalemia e a hipocalcemia (frequentemente secundária à hiperfosfatemia). A ocorrência de arritmias ou morte súbita são critérios definidores de SLT clínica, sublinhando a criticidade destas manifestações.
Impacto Arritmogênico da Hipercalemia
A hipercalemia exerce um impacto profundo na eletrofisiologia cardíaca, alterando o potencial de membrana e a excitabilidade celular. Esta alteração eleva significativamente o risco de arritmias ventriculares malignas, incluindo:
- Taquicardia Ventricular (TV)
- Fibrilação Ventricular (FV)
- Assistolia
Estas arritmias podem rapidamente culminar em parada cardíaca. A severidade do risco arritmogênico está correlacionada não apenas com o nível absoluto de potássio sérico, mas também com a velocidade de sua elevação e fatores individuais do paciente. O manejo da hipercalemia grave é uma emergência médica e envolve estratégias para:
- Estabilização da Membrana Cardíaca: Como a administração de gluconato de cálcio.
- Deslocamento do Potássio para o Meio Intracelular: Utilizando soluções de insulina e glicose.
- Aumento da Excreção de Potássio: Através de diuréticos, resinas de troca iônica ou, em casos refratários ou associados à LRA grave, hemodiálise.
Impacto Arritmogênico da Hipocalcemia
A hipocalcemia, ao reduzir a concentração de cálcio ionizado sérico, também compromete a estabilidade elétrica cardíaca. Sua principal manifestação eletrocardiográfica com potencial arritmogênico é:
- Prolongamento do Intervalo QT: Reflete um atraso na repolarização ventricular, aumentando o risco de desenvolver arritmias ventriculares polimórficas, como a Torsades de Pointes (TdP), que pode degenerar em FV.
Adicionalmente, a hipocalcemia severa pode impactar negativamente a contratilidade miocárdica.
Interações e Fatores Agravantes
É crucial reconhecer que a instabilidade elétrica cardíaca na SLT é frequentemente exacerbada pela coexistência de múltiplos distúrbios. A acidose metabólica, comum na SLT, particularmente na presença de lesão renal aguda, pode agravar a hipercalemia, intensificando o risco de arritmias. A interação sinérgica entre hipercalemia, hipocalcemia e acidose cria um ambiente particularmente perigoso para o coração.
Portanto, a monitorização cardíaca contínua e o manejo proativo e agressivo dos distúrbios eletrolíticos são fundamentais para a prevenção de eventos arrítmicos fatais em pacientes com SLT.
Outras Manifestações e Complicações Sistêmicas da SLT
Para além das alterações eletrolíticas primárias e da lesão renal aguda extensivamente discutidas, a Síndrome de Lise Tumoral (SLT) pode cursar com um conjunto adicional de manifestações sistêmicas que refletem a disrupção metabólica generalizada. Embora algumas possam ser secundárias aos distúrbios já abordados, sua presença contribui para o quadro clínico global e reforça a gravidade desta emergência oncológica.
Sintomatologia Geral Associada
Sintomas gerais inespecíficos são frequentemente observados em pacientes com SLT, podendo incluir:
- Distúrbios Gastrointestinais: Náuseas, vômitos e diarreia são comuns e podem contribuir para a depleção de volume, exacerbando os desequilíbrios hidroeletrolíticos e a lesão renal.
- Sintomas Constitucionais: Letargia, fadiga e mal-estar geral podem estar presentes, refletindo tanto a doença de base quanto o impacto sistêmico das alterações metabólicas.
Complicações Neurológicas Menos Específicas
Enquanto manifestações neuromusculares agudas como tetania e convulsões estão primariamente atreladas à hipocalcemia (como discutido previamente), outras alterações neurológicas podem surgir:
- Alterações do Estado Mental: Confusão, irritabilidade e desorientação podem ocorrer, sendo multifatoriais e influenciadas pelos diversos distúrbios eletrolíticos e metabólicos presentes.
Outras Complicações Sistêmicas
A desregulação metabólica pode levar a outras complicações importantes:
- Acidose Metabólica: Um achado comum, geralmente com ânion-gap aumentado, resultante da liberação de ácidos intracelulares (como fosfatos) e da eventual incapacidade renal de excretar a carga ácida. A acidose pode, por si só, agravar a hipercalemia.
- Insuficiência Cardíaca Congestiva (ICC): A ocorrência ou exacerbação da ICC pode ser observada, potencialmente relacionada à sobrecarga de volume secundária à lesão renal aguda ou a efeitos cardíacos diretos dos distúrbios eletrolíticos.
Potencial para Falência de Múltiplos Órgãos (FMO)
A SLT não tratada ou refratária ao tratamento pode progredir rapidamente, culminando em falência de múltiplos órgãos. Este desfecho representa a consequência final da cascata de eventos fisiopatológicos desencadeada pela lise tumoral maciça e está associado a uma elevada taxa de mortalidade. A identificação precoce das manifestações clínicas e laboratoriais, mesmo as menos específicas, é fundamental para instituir o manejo adequado e prevenir a progressão para este estado crítico.