A Doença de Crohn (DC) é uma doença inflamatória intestinal (DII) crônica e complexa, cuja etiologia é multifatorial. Este artigo explora em detalhes a etiopatogenia e a fisiopatologia da Doença de Crohn, abordando desde a definição e natureza multifatorial da doença até seus fatores etiológicos, resposta imune desregulada, as implicações terapêuticas do TNF-α e as complicações decorrentes da inflamação transmural. Compreender esses aspectos é crucial para o manejo eficaz da DC e para o desenvolvimento de futuras terapias.
Definição e Natureza Multifatorial da Doença de Crohn
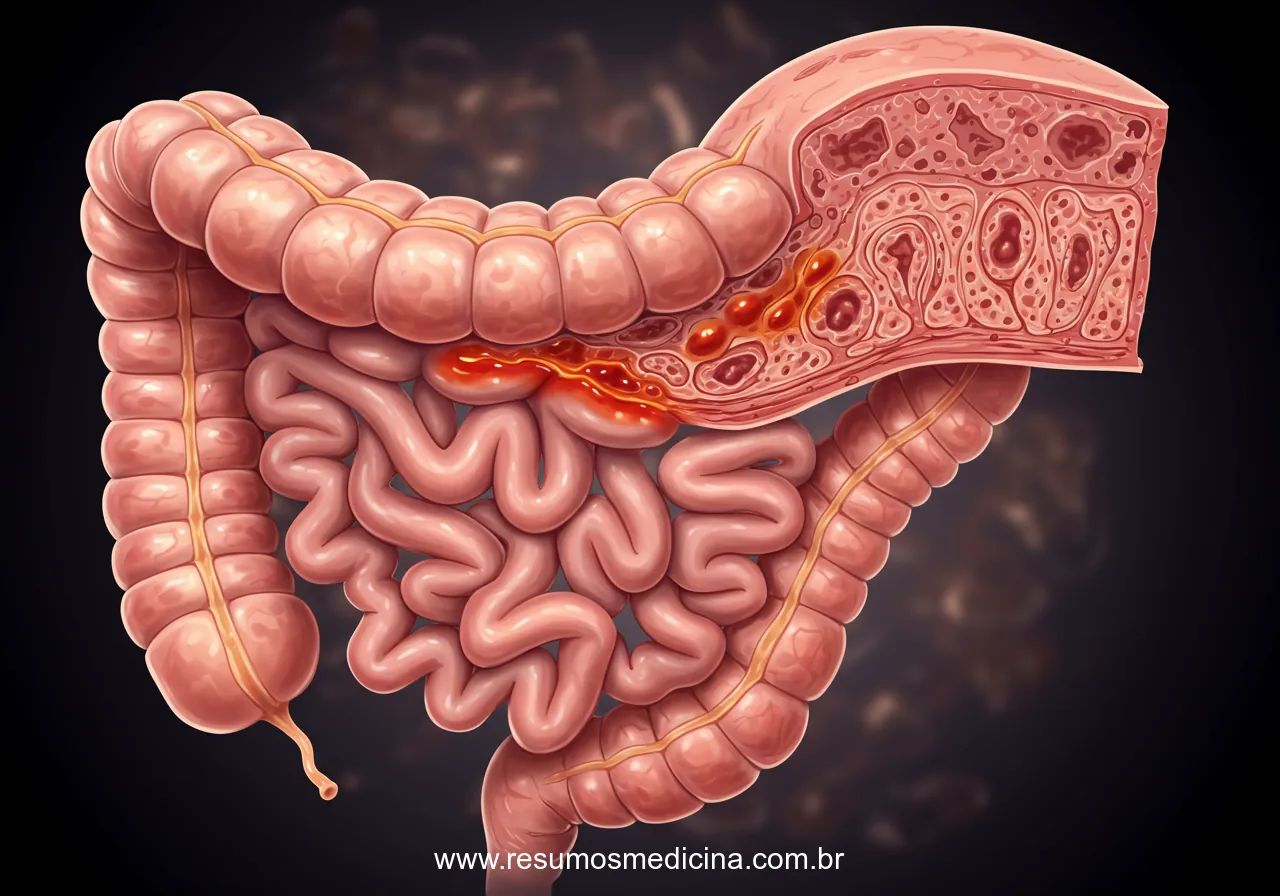
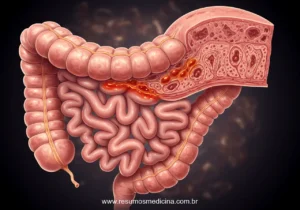
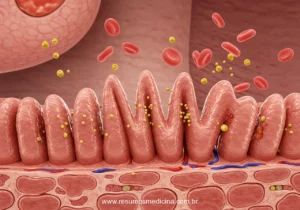
A Doença de Crohn (DC) é classificada como uma doença inflamatória intestinal (DII) de caráter crônico, cuja etiologia é reconhecida como complexa e multifatorial. Uma característica patológica fundamental da DC é a presença de uma inflamação transmural, ou seja, um processo inflamatório que acomete todas as camadas da parede intestinal – mucosa, submucosa, muscular e serosa. Esta profundidade da inflamação distingue a DC de outras formas de DII, como a retocolite ulcerativa, que tipicamente se restringe à mucosa, e é o fator subjacente ao desenvolvimento de complicações como estenoses (estreitamentos), fístulas (conexões anormais) e abscessos.
A DC pode afetar qualquer segmento do trato gastrointestinal, estendendo-se desde a boca até o ânus. No entanto, as localizações mais comuns de acometimento são o íleo terminal e o cólon. Outro aspecto característico da doença é o seu padrão de distribuição descontínuo ou segmentar, frequentemente descrito como ‘lesões em salto’ (skip lesions), onde áreas de inflamação ativa são intercaladas com segmentos de tecido intestinal aparentemente normais.
A etiopatogenia da Doença de Crohn não pode ser atribuída a um único fator causal, sendo o resultado de uma interação dinâmica e complexa entre diversos componentes. Os principais elementos implicados na sua origem e desenvolvimento incluem:
- Predisposição Genética: Existe uma clara suscetibilidade genética para a DC. Indivíduos com histórico familiar de DII apresentam um risco significativamente maior de desenvolver a doença. Múltiplos genes foram associados a essa predisposição, com destaque para mutações no gene NOD2/CARD15, que codifica um receptor intracelular de reconhecimento bacteriano. Embora essas mutações sejam fortemente associadas à DC, especialmente em populações específicas como os judeus asquenazes (onde a prevalência da doença é maior), elas não explicam a totalidade dos casos, indicando o envolvimento de outros loci genéticos.
- Disfunção do Sistema Imunológico: O elemento central na patogênese da DC é uma resposta imune desregulada e inadequada no ambiente intestinal. Observa-se uma perda da tolerância imunológica contra componentes da microbiota intestinal comensal ou outros antígenos presentes no lúmen intestinal. Esta resposta imune exacerbada é orquestrada principalmente por linfócitos T ativados (incluindo padrões de resposta Th1 e Th17) e pela produção aumentada de citocinas pró-inflamatórias, como o Fator de Necrose Tumoral alfa (TNF-α), Interleucina-12 (IL-12) e Interleucina-23 (IL-23). Essas citocinas perpetuam a cascata inflamatória e contribuem para o dano tecidual crônico.
- Fatores Ambientais: Diversos fatores ambientais demonstraram modular o risco e influenciar o curso da DC. O tabagismo é o fator de risco ambiental mais bem estabelecido, estando consistentemente associado não apenas a um maior risco de desenvolvimento da doença, mas também a um curso clínico mais agressivo e maior necessidade de intervenções cirúrgicas. Outros fatores, como a dieta e potenciais agentes infecciosos, também são investigados como possíveis gatilhos ou modificadores da resposta inflamatória em indivíduos suscetíveis.
- Microbiota Intestinal: Alterações na composição e função do ecossistema microbiano intestinal, um estado conhecido como disbiose, são consideradas fundamentais na etiopatogenia da DC. A interação entre uma microbiota alterada e o sistema imune da mucosa intestinal em um hospedeiro geneticamente predisposto parece ser um evento chave para desencadear e manter a inflamação crônica descontrolada.
- Disfunção da Barreira Epitelial Intestinal: Evidências sugerem que um defeito na função de barreira do epitélio intestinal, resultando em aumento da permeabilidade, pode ser um fator contribuinte. Essa disfunção permitiria a translocação de antígenos luminais (como produtos bacterianos) para as camadas mais profundas da parede intestinal, onde ativariam de forma excessiva o sistema imune da mucosa.
Portanto, a Doença de Crohn manifesta-se como resultado da convergência desses múltiplos fatores – genéticos, imunológicos, ambientais e microbianos. A complexa interação entre eles culmina no desenvolvimento da inflamação crônica, transmural e frequentemente segmentar que caracteriza a doença no trato gastrointestinal.
Fatores Etiológicos: Genética, Ambiente e Microbiota
A Doença de Crohn (DC) é uma entidade clínica complexa cuja etiopatogenia é reconhecida como multifatorial. Ela resulta de uma intrincada interação entre predisposição genética, diversos fatores ambientais, a composição da microbiota intestinal e a integridade da barreira epitelial, culminando em uma resposta imune desregulada no trato gastrointestinal de indivíduos suscetíveis.
Predisposição Genética
A suscetibilidade genética desempenha um papel crucial na DC. Diversos genes têm sido associados a um risco aumentado, sendo a associação mais forte e consistentemente reportada com mutações no gene NOD2/CARD15 (Nucleotide-binding oligomerization domain-containing protein 2). O NOD2 é um receptor de reconhecimento padrão intracelular que detecta componentes da parede bacteriana, especificamente o muramil dipeptídeo (MDP), e participa na ativação da resposta imune inata. Mutações neste gene parecem comprometer a adequada resposta imune à presença bacteriana, contribuindo para o estado inflamatório crônico. Além disso, observa-se uma prevalência aumentada da DC em certas populações étnicas, como os judeus asquenazes, reforçando o componente genético na sua etiologia. Contudo, a herança genética não explica a totalidade dos casos, indicando a necessidade de outros fatores para o desenvolvimento da doença.
Fatores Ambientais
Fatores ambientais atuam como moduladores ou gatilhos em indivíduos geneticamente predispostos. O tabagismo é o fator de risco ambiental mais bem estabelecido, associado não apenas ao desenvolvimento da DC, mas também a um curso clínico mais agressivo e maior necessidade de intervenções terapêuticas, incluindo cirurgia. A dieta também é considerada um fator influente, embora os componentes específicos e mecanismos exatos ainda estejam sob investigação. Infecções pregressas podem, potencialmente, desencadear ou agravar a inflamação. O uso de anti-inflamatórios não esteroidais (AINEs) tem sido associado a exacerbações da doença, possivelmente por aumentarem a permeabilidade intestinal e alterarem a microbiota, devendo ser utilizados com cautela por estes pacientes.
Microbiota Intestinal e Disfunção da Barreira
Alterações na composição e função da microbiota intestinal, um estado conhecido como disbiose, são consistentemente observadas em pacientes com DC e consideradas um elemento central na sua patogênese. A disbiose contribui para a perda da tolerância imunológica aos componentes da microbiota comensal. Em paralelo, ocorre frequentemente uma disfunção da barreira epitelial intestinal. Esta quebra da barreira aumenta a permeabilidade mucosa, permitindo a translocação de antígenos luminais (bacterianos ou dietéticos) para a lâmina própria. Esta exposição antigênica aumentada, em conjunto com a disbiose e a predisposição genética, desencadeia e perpetua uma resposta imune desregulada. Essa resposta é tipicamente mediada por células T (incluindo perfis Th1 e Th17), com produção exacerbada de citocinas pró-inflamatórias (como TNF-alfa, IL-12, IL-23), resultando na inflamação crônica transmural característica da DC.
Em suma, a etiopatogenia da DC envolve uma complexa interação sinérgica entre a carga genética do indivíduo, exposições ambientais específicas, alterações qualitativas e quantitativas da microbiota intestinal e a falha na manutenção da integridade da barreira mucosa. Estes fatores convergem para uma perda de homeostase imunológica intestinal, estabelecendo o ciclo vicioso inflamatório que caracteriza a doença.
Fisiopatologia: Resposta Imune Desregulada, Inflamação Transmural e Granulomas
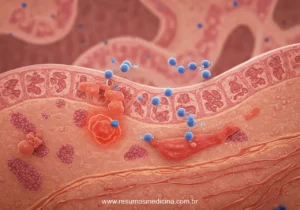
A fisiopatologia da Doença de Crohn (DC) é fundamentada em uma resposta imune desregulada no trato gastrointestinal, essencialmente uma perda da tolerância imunológica contra a microbiota intestinal comensal em indivíduos geneticamente predispostos. Esta disfunção leva a uma reatividade exacerbada do sistema imune a antígenos luminais.
A cascata inflamatória na DC envolve a ativação de linfócitos T, com evidências apontando para respostas predominantemente dos tipos Th1 e Th17. Essa ativação resulta na produção excessiva de um espectro de citocinas pró-inflamatórias, que são mediadores cruciais na perpetuação da inflamação e no dano tecidual. Entre as citocinas mais relevantes destacam-se o Fator de Necrose Tumoral alfa (TNF-α), a Interleucina-12 (IL-12), a Interleucina-23 (IL-23) e o Interferon-gama (IFN-γ).
Histologicamente, a DC distingue-se pela inflamação transmural, um processo que acomete todas as camadas da parede intestinal – mucosa, submucosa, muscular e serosa. Essa característica patológica é um diferencial importante em relação a outras doenças inflamatórias intestinais e está diretamente implicada no desenvolvimento de complicações penetrantes, como fístulas, e estenosantes. A distribuição da inflamação é tipicamente segmentar e descontínua, com áreas de inflamação ativa intercaladas com segmentos de intestino macroscopicamente normais, um padrão conhecido como ‘lesões em salto’ ou ‘skip lesions’.
Outro achado histopatológico característico, embora não universalmente presente, é a formação de granulomas não caseosos. Estes são agregados organizados de células inflamatórias, notavelmente macrófagos, que se formam na parede intestinal. A identificação de granulomas não caseosos em amostras de biópsia é um forte indicativo de DC, mas sua ausência não descarta o diagnóstico.
Adicionalmente, um fenômeno macroscópico frequentemente associado à inflamação crônica na DC é a ‘gordura rastejante’ (‘creeping fat’). Este termo descreve a hipertrofia e a migração do tecido adiposo mesentérico, que passa a envolver a superfície serosa do intestino inflamado, sendo um achado comum durante procedimentos cirúrgicos.
Papel do TNF-alfa e Implicações Terapêuticas (Anti-TNF e Imunomoduladores)
O Fator de Necrose Tumoral alfa (TNF-α) é reconhecido como uma citocina pró-inflamatória fundamental na patogênese da Doença de Crohn (DC). Produzido por células do sistema imune, como macrófagos e linfócitos T, o TNF-α desempenha um papel central na desregulação imune que caracteriza a doença. Sua superexpressão na mucosa intestinal contribui diretamente para a ativação e perpetuação da cascata inflamatória, o recrutamento e migração de células inflamatórias para o intestino, a produção de outras citocinas inflamatórias e a manutenção do estado inflamatório crônico, resultando em dano tecidual, sintomas clínicos e contribuindo para a fisiopatologia de complicações como as fístulas.
Agentes Anti-TNF: Mecanismo e Efeitos Terapêuticos
Dada a importância do TNF-α, o seu bloqueio constitui uma estratégia terapêutica central na DC. Os agentes anti-TNF, como o Infliximabe e o Adalimumabe, são anticorpos monoclonais projetados especificamente para neutralizar esta citocina. Esses agentes atuam ligando-se tanto ao TNF-α solúvel quanto ao TNF-α transmembrana. Essa ligação impede a interação do TNF-α com seus receptores celulares (TNFR1 e TNFR2), bloqueando assim a via de sinalização intracelular dependente desta citocina.
A inibição da sinalização do TNF-α pelos anticorpos monoclonais resulta numa série de efeitos anti-inflamatórios. Observa-se a redução na produção de outras citocinas e mediadores inflamatórios, a diminuição da expressão de moléculas de adesão na superfície celular (essenciais para o recrutamento leucocitário) e a atenuação geral da ativação de células inflamatórias. Adicionalmente, os anticorpos anti-TNF podem induzir a apoptose (morte celular programada) de células que expressam TNF-α em sua superfície, contribuindo para a resolução da inflamação.
Clinicamente, a neutralização do TNF-α traduz-se em benefícios terapêuticos significativos, incluindo a redução da inflamação intestinal, a promoção da cicatrização da mucosa, o controle eficaz dos sintomas da doença e a indução do fechamento de fístulas, uma complicação frequente e debilitante da DC.
Imunomoduladores: Azatioprina
Outra classe de medicamentos utilizada no manejo da DC são os imunomoduladores, como a Azatioprina. Este fármaco exerce seu efeito suprimindo o sistema imunológico de forma mais ampla. A Azatioprina é um pró-fármaco que é convertido metabolicamente em 6-mercaptopurina (6-MP). A 6-MP interfere na síntese de purinas, nucleotídeos essenciais para a replicação celular. Ao inibir a síntese de purinas, a Azatioprina/6-MP reduz a proliferação de células imunes, diminuindo consequentemente a produção de citocinas inflamatórias e a atividade inflamatória geral associada à Doença de Crohn.
Complicações Decorrentes da Inflamação Transmural: Estenoses, Fístulas e Perfurações
A natureza transmural da inflamação na Doença de Crohn (DC), afetando todas as camadas da parede intestinal (mucosa, submucosa, muscular e serosa), é um fator patogênico central que predispõe ao desenvolvimento de complicações estruturais significativas. A inflamação crônica, mediada por uma resposta imune desregulada e citocinas pró-inflamatórias, leva a alterações profundas na arquitetura intestinal, culminando em estenoses, fístulas e, em casos mais graves, perfurações.
Formação de Estenoses
As estenoses, ou estreitamentos da luz intestinal, são uma consequência frequente da inflamação transmural crônica na DC. O processo inflamatório persistente induz fibrogênese, caracterizada pela deposição de colágeno e remodelação da matriz extracelular, resultando em espessamento e rigidez da parede intestinal. A cicatrização repetida de áreas inflamadas contribui substancialmente para a formação dessas áreas de estreitamento. As estenoses podem ser classificadas com base no componente predominante:
- Estenoses Inflamatórias: Causadas principalmente por edema inflamatório agudo e infiltração celular na parede intestinal. Apresentam potencial de reversibilidade com terapia anti-inflamatória eficaz.
- Estenoses Fibróticas: Resultantes de um processo crônico de deposição de tecido cicatricial (fibrose). São tipicamente mais permanentes, menos responsivas ao tratamento medicamentoso e frequentemente necessitam de abordagens como dilatação endoscópica ou intervenção cirúrgica (estenoplastia ou ressecção intestinal) para restaurar a patência luminal.
Clinicamente, as estenoses podem manifestar-se como quadros de obstrução intestinal, que variam de parciais a totais, cursando com dor abdominal tipo cólica, distensão abdominal, náuseas, vômitos e alterações do trânsito intestinal. As localizações mais comuns de estenose na DC são o íleo terminal e o cólon, embora possam ocorrer em qualquer segmento do trato gastrointestinal.
Desenvolvimento de Fístulas
Fístulas são trajetos anormais que conectam duas superfícies epitelizadas. Na DC, sua gênese está diretamente ligada à profundidade da inflamação transmural. Ulcerações profundas e fissuras podem penetrar através de todas as camadas da parede intestinal, estendendo-se a estruturas ou órgãos adjacentes. A formação de abscessos secundários à inflamação transmural que, ao se romperem ou drenarem, podem criar e perpetuar esses trajetos fistulosos. A formação de fístulas é uma complicação comum e debilitante, decorrente da extensão da inflamação para além da parede intestinal, levando à erosão e formação de túneis.
As fístulas são classificadas de acordo com as estruturas envolvidas na conexão:
- Enteroentéricas: Entre dois segmentos intestinais.
- Enterocutâneas: Entre o intestino e a pele.
- Enterovesicais: Entre o intestino e a bexiga urinária.
- Enterovaginais: Entre o intestino e a vagina.
- Perianais ou Anorretais: Resultantes da extensão da inflamação transmural para a região perianal, conectando o canal anal ou reto à pele perianal. O acometimento perianal, incluindo fístulas, fissuras e abscessos, é frequente e pode indicar um curso mais agressivo da doença.
Risco de Perfuração Intestinal
A perfuração intestinal representa uma complicação grave e aguda da DC, associada a um elevado risco de morbimortalidade. Sua ocorrência está geralmente vinculada à inflamação transmural intensa e ativa, que pode levar à necrose tecidual, ou à complicação de abscessos intra-abdominais ou obstrução intestinal severa. Embora menos comum que estenoses e fístulas, a perfuração é uma emergência cirúrgica.
A perfuração pode manifestar-se de duas formas:
- Perfuração Livre: Ocorre quando há comunicação direta da luz intestinal com a cavidade peritoneal, resultando em extravasamento de conteúdo entérico e desenvolvimento de peritonite generalizada e sepse. Requer intervenção cirúrgica imediata.
- Perfuração Contida (Bloqueada): A perfuração é selada por estruturas adjacentes (omento, outras alças intestinais), levando à formação de um abscesso localizado.
O manejo cirúrgico da perfuração livre tipicamente envolve laparotomia exploradora, ressecção do segmento intestinal comprometido, lavagem peritoneal rigorosa e, dependendo das condições locais e clínicas do paciente, pode necessitar da criação de uma ostomia para desvio do trânsito fecal. A antibioticoterapia de amplo espectro é fundamental no controle da infecção associada.
Megacólon Tóxico
Embora classicamente associado à retocolite ulcerativa, o megacólon tóxico pode, menos frequentemente, complicar a evolução da DC, especialmente em casos de colite extensa e grave. Define-se pela dilatação aguda e acentuada do cólon (diâmetro do cólon transverso > 6 cm em radiografia simples), acompanhada por sinais de toxicidade sistêmica (febre, taquicardia, leucocitose, desidratação, alteração do estado mental). A fisiopatologia subjacente envolve inflamação transmural severa que se estende à camada muscular do cólon, comprometendo a sua contratilidade e motilidade e levando ao acúmulo de gás e conteúdo fecal. O megacólon tóxico é uma emergência médica que exige manejo clínico intensivo e, frequentemente, intervenção cirúrgica urgente (colectomia total ou subtotal) para prevenir a perfuração e controlar a sepse.
Conclusão
A Doença de Crohn é uma patologia complexa, resultante da interação entre fatores genéticos, ambientais, imunológicos e da microbiota intestinal. A inflamação transmural característica da doença leva a complicações significativas como estenoses, fístulas e perfurações, impactando a qualidade de vida dos pacientes. O entendimento aprofundado da etiopatogenia e fisiopatologia da DC é fundamental para o desenvolvimento de estratégias terapêuticas eficazes, como o uso de agentes anti-TNF e imunomoduladores, visando o controle da inflamação e a prevenção de complicações.