A Doença Celíaca (DC) é uma enteropatia crônica, autoimune e imunomediada, que afeta a mucosa do intestino delgado. Esta condição sistêmica é desencadeada pela ingestão de glúten em indivíduos geneticamente predispostos. Este artigo explora a etiopatogenia e a fisiopatologia da doença celíaca, abordando desde os fatores genéticos e ambientais até os mecanismos imunológicos envolvidos na resposta ao glúten, as lesões intestinais características e as consequências da má absorção de nutrientes.
Definição e Etiopatogenia da Doença Celíaca
A Doença Celíaca (DC) é definida como uma enteropatia autoimune crônica, desencadeada pela ingestão de glúten em indivíduos com predisposição genética. O glúten, um complexo proteico encontrado em cereais como trigo (gliadina), cevada (hordeína) e centeio (secalina), é o fator ambiental essencial para o desenvolvimento da doença. A aveia (avenina) pode ser problemática devido à contaminação cruzada ou reações em subgrupos específicos de pacientes.
A etiopatogenia da DC envolve a interação entre fatores genéticos, ambientais e imunológicos. A predisposição genética, associada aos haplótipos HLA-DQ2 e HLA-DQ8, é crucial, mas não suficiente para causar a doença. A exposição ao glúten induz uma resposta imunológica inadequada na mucosa do intestino delgado, mediada pela imunidade inata e adaptativa, levando a lesões e atrofia das vilosidades intestinais, comprometendo a absorção intestinal.
Fatores Genéticos e Ambientais na Suscetibilidade
Predisposição Genética: O Papel do HLA
A base genética da suscetibilidade à doença celíaca está fortemente associada aos alelos HLA-DQ2 e HLA-DQ8, essenciais para a apresentação de peptídeos de gliadina aos linfócitos T CD4+, iniciando a cascata imunológica. No entanto, a presença destes haplótipos HLA não é suficiente para o desenvolvimento da doença, indicando a necessidade de outros fatores.
Fatores Ambientais Moduladores
Além da predisposição genética e da exposição ao glúten, outros fatores ambientais podem modular o risco de DC:
- Idade de Introdução do Glúten: A introdução tardia do glúten pode estar associada a um menor risco ou atraso no aparecimento da doença.
- Duração da Amamentação: A amamentação prolongada pode conferir proteção ou retardar o início da DC em crianças geneticamente predispostas.
- Infecções Gastrointestinais: Podem influenciar o risco de desenvolvimento da DC, alterando a permeabilidade intestinal ou modulando a resposta imune local.
A suscetibilidade à DC resulta de uma interação complexa entre a predisposição genética (HLA-DQ2 e HLA-DQ8) e fatores ambientais, como o padrão de exposição ao glúten, infecções e práticas alimentares na infância.
O Papel do Glúten e Seus Componentes Imunogênicos
O glúten é o principal gatilho ambiental para a doença celíaca. As frações mais imunogênicas são:
- Gliadina: Fração do trigo, principal antígeno na DC.
- Secalina: Fração do centeio.
- Hordeína: Fração da cevada.
A resistência da gliadina à digestão completa resulta na formação de peptídeos que penetram na mucosa intestinal e iniciam a resposta imune. A aveia pode ser tolerada, mas a contaminação cruzada com outros cereais contendo glúten é um risco.
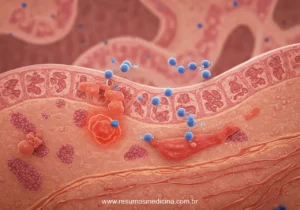
Mecanismos Imunológicos: A Resposta ao Glúten
A resposta imunológica é iniciada pela ingestão de glúten em indivíduos geneticamente suscetíveis. A gliadina, resistente à digestão, é o principal agente imunogênico.
Processamento da Gliadina e Aumento da Imunogenicidade
Peptídeos de gliadina atravessam a barreira epitelial e interagem com a transglutaminase tecidual (tTG), que desamida resíduos de glutamina, aumentando a afinidade dos peptídeos pelas moléculas HLA-DQ2 ou HLA-DQ8 e elevando sua imunogenicidade.
Apresentação Antigênica e Ativação da Resposta Imune
As células apresentadoras de antígenos (APCs) processam os peptídeos de gliadina desamidada e os apresentam acoplados às moléculas HLA-DQ2 ou HLA-DQ8, sendo reconhecidos por linfócitos T CD4+, desencadeando a ativação da resposta imune inata e adaptativa.
Liberação de Citocinas e Ativação de Linfócitos B
A ativação dos linfócitos T CD4+ resulta na liberação de citocinas pró-inflamatórias, como o interferon-gama (IFN-γ) e a interleucina-21 (IL-21), que contribuem para o dano tecidual e a inflamação da mucosa intestinal. Os linfócitos T CD4+ ativam os linfócitos B, que se diferenciam em plasmócitos, produzindo anticorpos específicos contra a gliadina (anti-DGP), a transglutaminase tecidual (anti-tTG) e o endomísio (EMA).
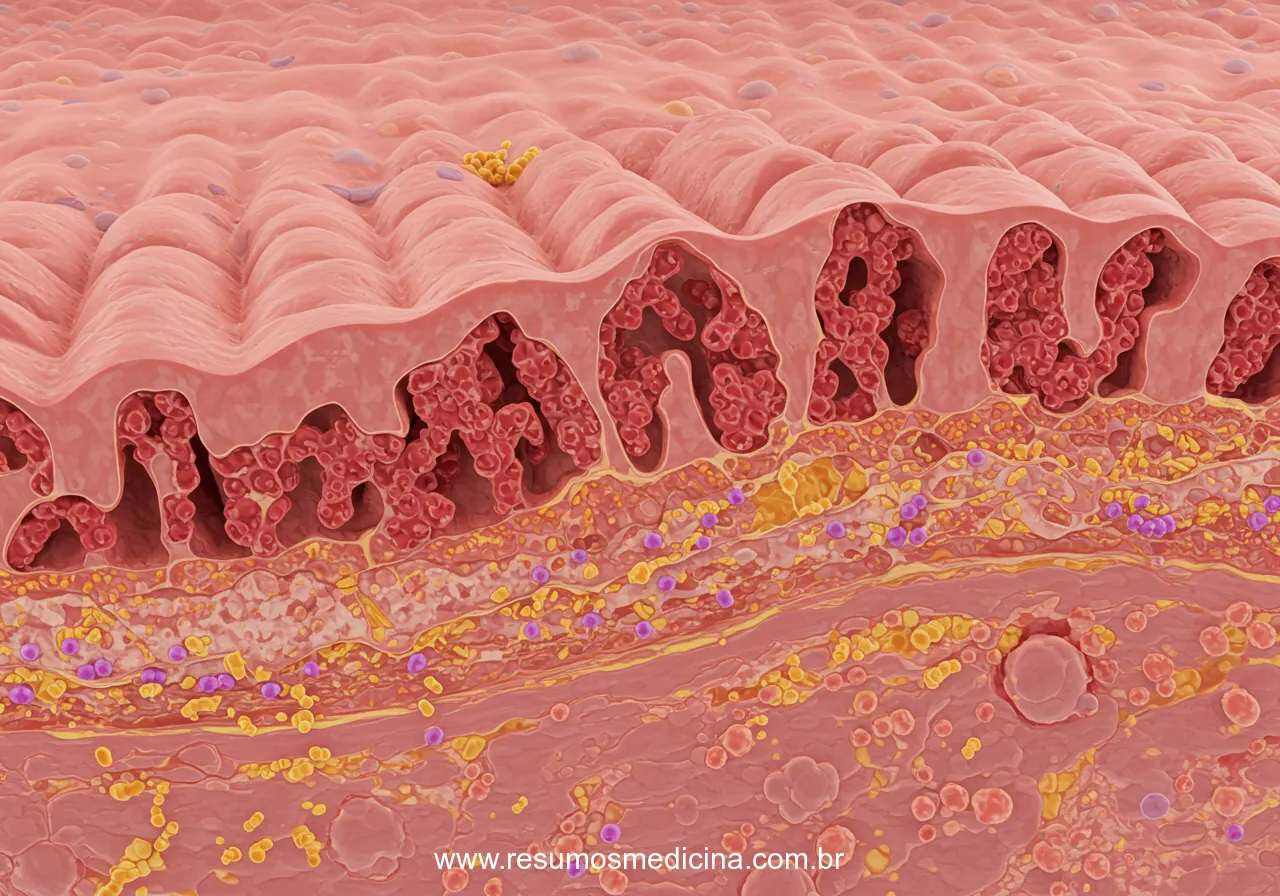
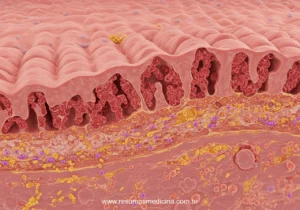
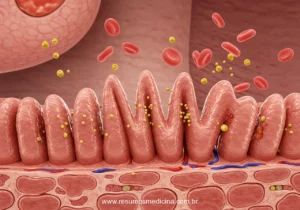
Fisiopatologia da Lesão Intestinal: Atrofia Vilositária e Hiperplasia das Criptas
A resposta imune crônica ao glúten induz uma inflamação persistente na mucosa do intestino delgado, levando a alterações histológicas marcantes e à reestruturação da arquitetura intestinal.
As principais características histopatológicas incluem:
- Atrofia das vilosidades intestinais: Destruição progressiva das vilosidades, comprometendo a capacidade de absorção.
- Hiperplasia das criptas: Aumento da atividade proliferativa nas criptas de Lieberkühn, tentando regenerar o epitélio danificado.
- Aumento da infiltração de linfócitos intraepiteliais (LIEs): Acúmulo de linfócitos no compartimento epitelial e na lâmina própria.
A combinação de atrofia vilositária e hiperplasia das criptas reduz a área de superfície para a absorção de nutrientes, levando à má absorção e às manifestações clínicas da doença celíaca.
Consequências Fisiopatológicas: Má Absorção de Nutrientes e Manifestações Clínicas
A inflamação crônica da mucosa do intestino delgado resulta em uma alteração significativa da arquitetura intestinal, com atrofia das vilosidades e hiperplasia das criptas, levando à redução drástica da área de superfície disponível para a digestão terminal e a absorção de nutrientes.
Impacto na Absorção de Macro e Micronutrientes
Essa diminuição da capacidade absortiva intestinal leva a uma má absorção generalizada, afetando tanto macronutrientes (carboidratos, proteínas e gorduras) quanto micronutrientes (vitaminas e minerais), resultando em esteatorreia (presença de gordura nas fezes).
Deficiências Nutricionais Específicas e Manifestações Clínicas
A má absorção global de nutrientes contribui diretamente para manifestações clínicas sistêmicas e gastrointestinais. Sintomas comuns incluem diarreia crônica, perda de peso significativa, desnutrição e, em crianças, déficit de crescimento. Diversas deficiências específicas podem ocorrer:
- Má Absorção de Ferro: Leva à anemia ferropriva (microcítica e hipocrômica), com fadiga, palidez e dispneia.
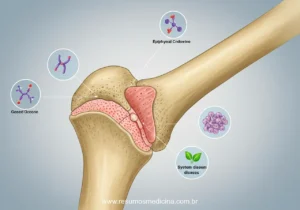
- Má Absorção de Vitaminas Lipossolúveis (A, D, E, K): A deficiência de vitamina D é particularmente relevante, levando a raquitismo em crianças e osteomalácia ou osteoporose em adultos. Deficiências de outras vitaminas lipossolúveis podem causar alterações visuais (vitamina A), neuropatia (vitamina E) e distúrbios de coagulação (vitamina K).
- Má Absorção de Cálcio: Contribui para a doença óssea (osteopenia, osteoporose) observada em pacientes celíacos.
- Outras Deficiências: A má absorção proteica pode levar à hipoalbuminemia. Deficiências vitamínicas e minerais diversas contribuem para o quadro geral de desnutrição e manifestações clínicas variadas.
Conclusão
A doença celíaca é uma condição complexa, influenciada por fatores genéticos, ambientais e imunológicos. A compreensão detalhada da etiopatogenia e fisiopatologia da DC é crucial para o diagnóstico preciso e o manejo adequado dos pacientes. A atrofia vilositária, resultante da resposta imune ao glúten, inicia uma cascata de eventos fisiopatológicos centrados na má absorção, resultando em um amplo espectro de deficiências nutricionais e manifestações clínicas que podem impactar significativamente a saúde do paciente. O manejo da doença celíaca baseia-se principalmente na adesão a uma dieta isenta de glúten para mitigar a resposta imune e promover a recuperação da mucosa intestinal, prevenindo, dessa forma, suas complicações a longo prazo.