O diagnóstico e estadiamento do câncer de pâncreas representam um campo complexo e desafiador na oncologia. Este artigo abordará de forma detalhada os aspectos clínicos, os métodos de imagem, os biomarcadores e os critérios de estadiamento e ressecabilidade essenciais para a correta avaliação e manejo desta neoplasia.
Introdução: Desafios Diagnósticos e Impacto Prognóstico
O adenocarcinoma pancreático apresenta desafios diagnósticos substanciais, primordialmente pela sua natureza insidiosa, frequentemente assintomática nos estágios primários, e pela ausência de métodos de rastreamento eficazes e validados para aplicação na população geral. A manifestação clínica tende a ser tardia, frequentemente marcada por sintomatologia inespecífica como dor abdominal, perda ponderal inexplicada e alterações do apetite, o que culmina, em muitos casos, no diagnóstico em fases avançadas da enfermidade.
Esta dificuldade intrínseca na detecção precoce exerce um impacto direto sobre o prognóstico do paciente. O diagnóstico em estágios iniciais é fundamental, uma vez que a sobrevida global em 5 anos demonstra correlação direta com o estadiamento da doença no momento da sua identificação. Tumores identificados em fases mais precoces apresentam uma maior probabilidade de serem classificados como ressecáveis cirurgicamente.
A ressecção cirúrgica com margens livres (R0), seja por pancreatoduodenectomia ou pancreatectomia distal, permanece como a única modalidade terapêutica com potencial curativo para o câncer de pâncreas. Consequentemente, a identificação da doença em um estágio onde a intervenção cirúrgica é tecnicamente viável e oncologicamente adequada é crucial para oferecer ao paciente a melhor perspectiva de cura e influenciar positivamente a sobrevida a longo prazo, embora a necessidade de terapia adjuvante seja frequente mesmo após ressecções R0, dada a alta taxa de recidiva.
Apresentação Clínica: Sinais, Sintomas e Variações Anatômicas
As manifestações clínicas do câncer de pâncreas são frequentemente variáveis e podem depender diretamente da localização e do tamanho do tumor. Muitos sintomas são inespecíficos, o que pode retardar a suspeita diagnóstica.
Sintomas Comuns e Manifestações Associadas
Os sintomas mais prevalentes associados ao adenocarcinoma pancreático incluem uma combinação dos seguintes:
- Dor Abdominal: Frequentemente localizada na região epigástrica ou quadrante superior, com característica irradiação para o dorso ou em faixa. A dor pode ser inicialmente vaga, tornando-se progressivamente mais intensa.
- Perda de Peso Inexplicada: Perda ponderal significativa e progressiva, muitas vezes definida como superior a 5% do peso corporal habitual em um período de 6 a 12 meses, é um sinal de alerta frequente.
- Icterícia Obstrutiva: Manifesta-se como coloração amarelada da pele e das escleras, resultante da obstrução do fluxo biliar impedindo a drenagem para o duodeno. É mais comum em tumores da cabeça pancreática.
- Colúria e Acolia Fecal: Urina escura (cor de coca-cola) devido à excreção renal de bilirrubina conjugada e fezes claras/esbranquiçadas pela ausência de pigmentos biliares no trato intestinal, respectivamente. São consequências diretas da obstrução biliar.
- Prurido: Coceira generalizada que pode acompanhar a icterícia, atribuída à deposição de sais biliares na pele.
- Sintomas Gastrointestinais: Anorexia (perda de apetite), náuseas, vômitos e alterações do hábito intestinal são comuns. Empachamento pós-prandial pode ocorrer devido à compressão ou invasão direta do duodeno pelo tumor.
- Sintomas Sistêmicos: Fadiga, astenia e mal-estar geral são queixas frequentes, contribuindo para o quadro de declínio do estado geral.
- Manifestações Metabólicas e Paraneoplásicas: O surgimento de Diabetes Mellitus de início recente, especialmente em pacientes sem fatores de risco clássicos, pode ser um sinal de alerta. Pancreatite aguda recorrente sem causa evidente também pode ser uma forma de apresentação. A tromboflebite migratória superficial (Síndrome de Trousseau) é um sinal paraneoplásico associado a esta e outras neoplasias.
Influência da Localização Anatômica do Tumor
A localização do tumor primário no parênquima pancreático (cabeça, corpo ou cauda) influencia diretamente a apresentação clínica e, consequentemente, o momento do diagnóstico:
- Tumores na Cabeça do Pâncreas: Representam a maioria dos casos. Devido à estreita relação anatômica com o ducto biliar comum (colédoco), frequentemente causam compressão ou invasão ductal precocemente, levando à icterícia obstrutiva como manifestação inicial, acompanhada de colúria, acolia fecal e prurido. Dor abdominal e perda de peso também são comuns.
- Tumores no Corpo e Cauda do Pâncreas: Tendem a permanecer assintomáticos por períodos mais prolongados, o que frequentemente resulta em diagnóstico em estágios mais avançados. Os sintomas costumam ser mais vagos, como dor abdominal de difícil caracterização, perda de peso acentuada, anorexia, fadiga e, ocasionalmente, diabetes de início recente ou a Síndrome de Trousseau.
Icterícia Obstrutiva e Sinal de Courvoisier-Terrier
A icterícia no contexto do câncer de pâncreas é tipicamente do tipo obstrutiva (colestática), causada pela obstrução mecânica da drenagem biliar, mais comumente por tumores cefálicos. A obstrução impede o fluxo de bile para o duodeno, levando ao acúmulo de bilirrubina conjugada (direta) no sangue e sua deposição nos tecidos.
O Sinal de Courvoisier-Terrier é um achado semiológico relevante neste contexto. Descreve a presença de uma vesícula biliar palpável, aumentada de volume (distendida), mas caracteristicamente indolor, em um paciente com icterícia. A fisiopatologia explica-se pela obstrução gradual e progressiva da via biliar distal ao ducto cístico (geralmente por uma neoplasia da cabeça do pâncreas, periampular ou do colédoco distal). Essa progressão lenta permite que a vesícula se distenda adaptativamente, sem gerar o processo inflamatório agudo e a dor intensa que tipicamente acompanham obstruções súbitas por cálculos biliares. Nestes últimos casos (colelitíase), a vesícula frequentemente se encontra cronicamente inflamada, com paredes espessadas ou fibróticas, tornando-se não distensível e raramente palpável. Portanto, a presença do Sinal de Courvoisier-Terrier aponta fortemente para uma etiologia neoplásica como causa da obstrução biliar.
Diagnóstico por Imagem: Modalidades e Achados Fundamentais
A avaliação por imagem é um pilar essencial no diagnóstico, estadiamento e planejamento terapêutico do câncer de pâncreas, abrangendo tanto o adenocarcinoma ductal quanto as neoplasias císticas. As diferentes modalidades de imagem fornecem informações complementares cruciais para a caracterização da lesão e a determinação da extensão da doença.
Ultrassonografia Abdominal (US)
A ultrassonografia abdominal pode ser utilizada como um exame inicial, especialmente na investigação de pacientes com icterícia. Contudo, sua sensibilidade na detecção direta de tumores pancreáticos é limitada, particularmente para lesões de menores dimensões.
Tomografia Computadorizada (TC)
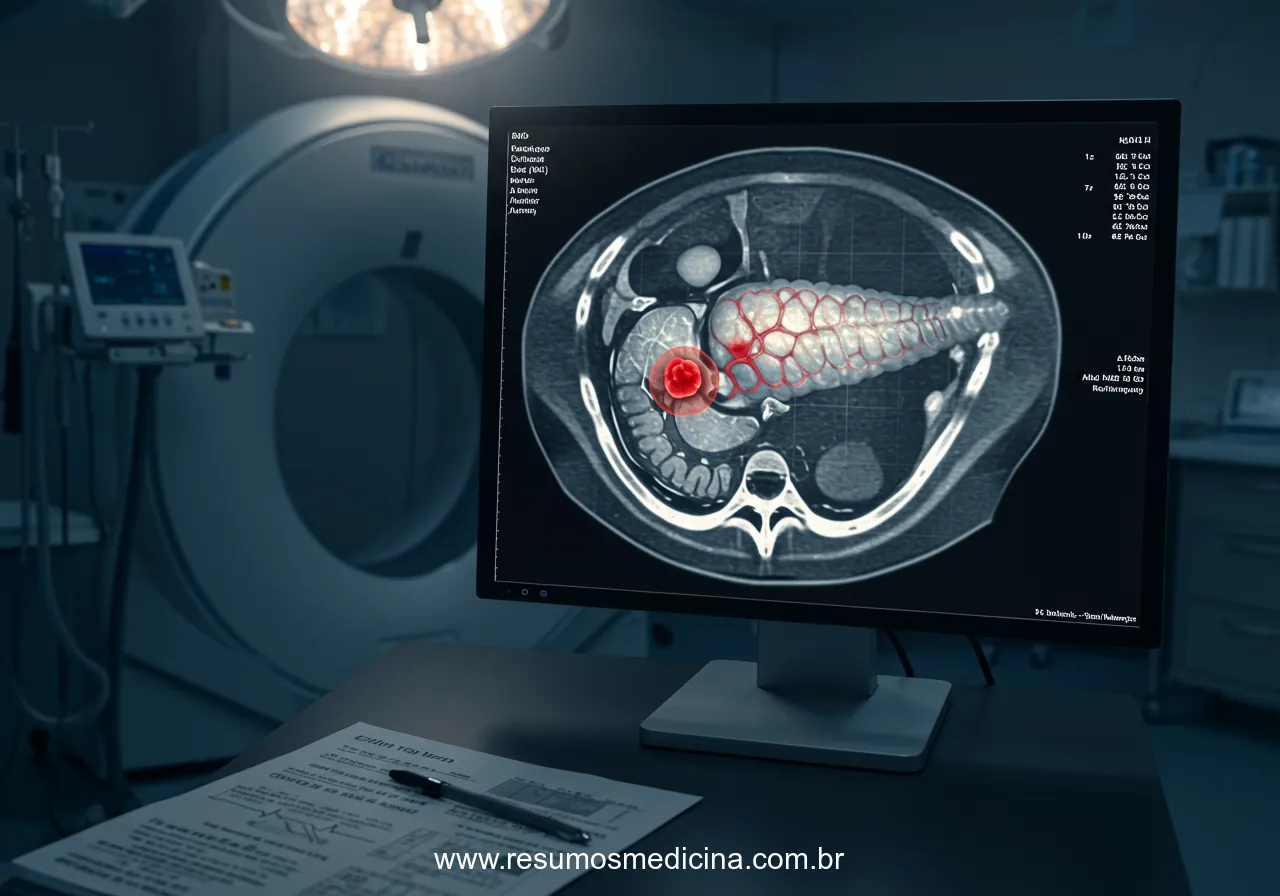
A Tomografia Computadorizada (TC) com contraste intravenoso, realizada com protocolo específico para pâncreas, é amplamente considerada a modalidade de imagem de primeira linha para o diagnóstico e estadiamento inicial. Ela fornece informações detalhadas sobre:
- Caracterização do Tumor Primário: Localização, dimensões e extensão da massa tumoral.
- Avaliação Vascular: Relação do tumor com vasos críticos, como a artéria mesentérica superior (AMS), tronco celíaco (TC), veia mesentérica superior (VMS) e veia porta (VP). Essa avaliação é fundamental para determinar os critérios de ressecabilidade.
- Detecção de Metástases: Identificação de disseminação para linfonodos regionais ou à distância, bem como metástases hepáticas ou peritoneais. Frequentemente, um estadiamento completo requer TC de tórax, abdome e pelve.
- Avaliação de Lesões Císticas: Identifica características como tamanho, localização e, em alguns casos, calcificações ou septações grosseiras.
Ressonância Magnética (RM) e Colangiopancreatorressonância (CPRM)
A Ressonância Magnética (RM), frequentemente associada à Colangiopancreatorressonância (CPRM), funciona como uma alternativa ou um complemento à TC. Sua utilidade se destaca em cenários específicos:
- Caracterização Superior de Lesões Císticas: Oferece melhor detalhamento tecidual do conteúdo interno, identificando septos finos, nódulos murais e a comunicação da lesão com o sistema ductal pancreático.
- Avaliação Vascular Detalhada: Pode fornecer informações adicionais sobre a relação do tumor com estruturas vasculares, auxiliando na avaliação da ressecabilidade.
- Detecção de Metástases Hepáticas: Apresenta alta sensibilidade para identificar e caracterizar lesões hepáticas suspeitas.
- Situações de Contraindicação à TC: Útil em pacientes com alergia ao contraste iodado ou insuficiência renal significativa.
Ultrassonografia Endoscópica (USE ou Ecoendoscopia)
A Ultrassonografia Endoscópica (USE) é uma técnica avançada que fornece imagens de alta resolução do pâncreas e estruturas adjacentes. É considerada o método padrão-ouro para a avaliação morfológica detalhada, especialmente de lesões císticas. Suas principais contribuições incluem:
- Imagem de Alta Resolução: Visualização detalhada do parênquima pancreático, ductos pancreáticos e biliares, paredes dos órgãos adjacentes e linfonodos.
- Estadiamento Locorregional (T e N): Permite avaliação precisa da profundidade da invasão tumoral (T) e do acometimento de linfonodos regionais (N).
- Punção Aspirativa por Agulha Fina (PAAF): Possibilita a obtenção guiada de amostras para análise citológica (confirmação histopatológica) e de fluido cístico. A análise do fluido (dosagem de CEA, amilase, marcadores moleculares) é crucial no diagnóstico diferencial das neoplasias císticas (níveis elevados de CEA sugerem neoplasias mucinosas; níveis elevados de amilase podem indicar comunicação com o ducto). A citologia pode detectar malignidade, embora sua sensibilidade seja limitada (um resultado negativo não exclui câncer).
- Biopsia em Casos Selecionados: A PAAF guiada por USE é fundamental para confirmação diagnóstica em tumores irressecáveis, borderline ou quando há dúvida diagnóstica. Para lesões consideradas claramente ressecáveis com base na TC ou RM, a biópsia pré-operatória é frequentemente evitada devido aos riscos potenciais (disseminação tumoral, pancreatite), realizando-se o diagnóstico histopatológico definitivo na peça cirúrgica.
Colangiopancreatografia Retrógrada Endoscópica (CPRE)
A CPRE desempenha um papel majoritariamente terapêutico no manejo do câncer de pâncreas. Sua principal indicação é a descompressão da via biliar em casos de icterícia obstrutiva, realizada através da inserção de próteses (stents) biliares. Embora tecnicamente possível obter amostras de tecido (escovado, biópsia) do ducto biliar ou pancreático durante o procedimento, a CPRE não é considerada uma ferramenta primária para o diagnóstico ou estadiamento do tumor pancreático propriamente dito, nem é utilizada para a ressecção tumoral.
Confirmação Histopatológica e Marcadores Tumorais
A confirmação histopatológica é um passo essencial no diagnóstico definitivo do câncer de pâncreas. A obtenção de amostras teciduais ou citológicas é frequentemente realizada através da Punção Aspirativa por Agulha Fina (PAAF) guiada por Ultrassonografia Endoscópica (USE), conforme detalhado na seção sobre diagnóstico por imagem. A análise citológica do material obtido via PAAF pode detectar células atípicas ou malignas, embora sua sensibilidade para confirmar malignidade possua limitações; um resultado negativo não exclui a presença de câncer.
Contudo, em cenários onde os achados de imagem são altamente sugestivos de adenocarcinoma pancreático e o tumor é considerado claramente ressecável, a biópsia pré-operatória não é universalmente mandatória e pode ser evitada. Nesses casos, a confirmação diagnóstica e a análise histopatológica definitiva são realizadas na peça cirúrgica após a ressecção, minimizando riscos associados à biópsia prévia, como disseminação tumoral ou pancreatite.
Marcadores Tumorais no Câncer de Pâncreas
Os marcadores tumorais séricos atuam como ferramentas coadjuvantes no manejo do câncer de pâncreas, sendo mais relevantes para o acompanhamento pós-diagnóstico do que para o rastreamento ou diagnóstico inicial, dada a sua especificidade e sensibilidade limitadas.
CA 19-9 (Antígeno Carboidrato 19-9)
O CA 19-9 é o marcador sérico mais utilizado associado ao adenocarcinoma pancreático. Suas aplicações e limitações incluem:
- Monitoramento da Resposta Terapêutica e Detecção de Recidiva: A principal utilidade do CA 19-9 reside no seguimento de pacientes, avaliando a resposta a tratamentos como quimioterapia ou cirurgia, e na detecção precoce de recorrência da doença. Quedas nos níveis podem indicar resposta favorável, enquanto elevações podem sinalizar progressão ou recidiva.
- Valor Prognóstico: Níveis séricos pré-tratamento ou pós-operatórios persistentemente elevados podem estar associados a um pior prognóstico. Níveis muito elevados podem sugerir doença metastática extensa ou a presença de micrometástases.
- Baixa Especificidade e Sensibilidade Diagnóstica: O CA 19-9 pode estar elevado em outras neoplasias (gastrointestinais, biliares) e em condições benignas (pancreatite, doenças hepáticas, obstrução biliar). Por isso, não é adequado para rastreamento populacional ou diagnóstico isolado.
- Impacto da Obstrução Biliar: A icterícia obstrutiva, comum em tumores cefálicos, impede a excreção biliar normal do CA 19-9, resultando em uma elevação falsamente acentuada dos níveis séricos. Este fato dificulta a interpretação do marcador em pacientes ictéricos antes da restauração da drenagem biliar.
- Fenótipo Lewis Negativo: Aproximadamente 5-10% da população possui o fenótipo sanguíneo Lewis (a-b-), que não expressa o antígeno CA 19-9. Nestes indivíduos, o marcador será indetectável e, portanto, clinicamente inútil.
CEA (Antígeno Carcinoembrionário)
O CEA é um marcador tumoral secundário no contexto do câncer de pâncreas. Apresenta menor sensibilidade e especificidade que o CA 19-9 para esta neoplasia, podendo estar elevado em diversos outros tumores e condições benignas. Sua utilidade pode ser considerada em conjunto com o CA 19-9, mas também não serve como ferramenta de rastreamento.
Análise de Marcadores no Fluido Cístico (Neoplasias Císticas)
Na avaliação de neoplasias císticas do pâncreas (NCPs), a análise do fluido obtido por EUS-PAAF fornece informações diagnósticas valiosas:
- CEA no Fluido Cístico: Níveis elevados de CEA são fortemente sugestivos de neoplasias mucinosas, como a Neoplasia Mucinosa Cística (NMC) e a Neoplasia Papilífera Intraductal Mucinosa (IPMN), auxiliando na diferenciação com lesões serosas ou pseudocistos, que tipicamente apresentam níveis baixos.
- Amilase no Fluido Cístico: Níveis elevados de amilase indicam comunicação da lesão cística com o sistema ductal pancreático, achado menos comum em cistoadenomas serosos.
- Mucina no Fluido Cístico: A identificação de mucina é característica das neoplasias mucinosas.
Estes marcadores no fluido cístico, juntamente com a citologia, auxiliam na classificação das NCPs e na avaliação do potencial de malignidade.
Outros Marcadores
A pesquisa por biomarcadores mais sensíveis e específicos para o diagnóstico precoce e monitoramento do câncer de pâncreas é contínua, mas outros marcadores ainda se encontram em fase de investigação e não são rotineiramente empregados na prática clínica.
Estadiamento TNM e Critérios de Ressecabilidade
A classificação precisa da extensão anatômica do adenocarcinoma pancreático é realizada através do sistema de estadiamento TNM, conforme padronizado pela AJCC (American Joint Committee on Cancer). Este sistema é essencial para a determinação do prognóstico e para guiar as decisões terapêuticas.
Sistema de Estadiamento TNM
O estadiamento TNM compreende a avaliação de três componentes fundamentais:
- T (Tumor): Avalia o tamanho do tumor primário e sua extensão local, incluindo a invasão de estruturas adjacentes, como o duodeno, a via biliar ou grandes vasos.
- N (Nódulo): Descreve a presença e a extensão do acometimento de linfonodos regionais pela neoplasia. O status linfonodal (N0, N1, N2) é um fator prognóstico significativo.
- M (Metástase): Indica a presença (M1) ou ausência (M0) de metástases à distância. Locais comuns de metástases incluem o fígado, peritônio, pulmões e linfonodos não regionais. A presença de metástases (Estádio IV) geralmente contraindica a ressecção cirúrgica com intenção curativa.
Critérios de Ressecabilidade
A avaliação da ressecabilidade é um passo crucial para determinar a viabilidade da remoção cirúrgica do tumor, baseando-se essencialmente na relação do tumor com estruturas vasculares críticas e na ausência de doença metastática. Os tumores são classificados em três categorias principais, com base em achados de imagem (principalmente TC e RM):
- Ressecável: Definido pela ausência de metástases à distância (M0) e pela ausência de contato ou envolvimento tumoral com a artéria mesentérica superior (AMS), o tronco celíaco (TC) e a artéria hepática comum (AHC). O contato com a veia mesentérica superior (VMS) ou veia porta (VP) sem deformidade ou trombose, ou um envolvimento que permita a ressecção e reconstrução vascular segura, é aceitável.
- Borderline Ressecável (Limítrofe): Apresenta características radiológicas que tornam a ressecção R0 (margens microscopicamente livres) incerta, mas potencialmente alcançável, muitas vezes após terapia neoadjuvante. Inclui: contato tumoral com AMS ou TC menor que 180 graus sem extensão à aorta; contato ou encasement da AHC sem extensão ao TC; envolvimento da VMS/VP (encasement < 180 graus, ou oclusão de segmento curto passível de reconstrução); contato com o ramo de drenagem jejunal mais proximal da VMS.
- Irressecável: A ressecção curativa não é considerada viável. Os critérios incluem: presença de metástases à distância (M1 – hepáticas, peritoneais, pulmonares, etc.); envolvimento circunferencial (encasement > 180 graus) da AMS ou TC; invasão da aorta; oclusão ou trombose da VMS ou VP que não permite reconstrução vascular segura; envolvimento de órgãos adjacentes que impossibilita a ressecção completa.
É importante notar que mesmo em pacientes submetidos à ressecção cirúrgica com margens livres (R0), o risco de recidiva da doença permanece elevado. A sobrevida global em 5 anos após a ressecção R0 situa-se historicamente entre 20-30%, destacando a importância fundamental da terapia sistêmica adjuvante (como quimioterapia) como parte integrante do tratamento com intenção curativa.
Diagnóstico Diferencial e Abordagem das Neoplasias Císticas Pancreáticas
A identificação de Lesões Císticas Pancreáticas (LCPs) demanda uma avaliação criteriosa para o diagnóstico diferencial, fundamentalmente distinguindo as Neoplasias Císticas Pancreáticas (NCPs) dos Pseudocistos Pancreáticos. A diferenciação é crucial, pois as NCPs possuem potencial variável de malignização, enquanto os pseudocistos são coleções pós-inflamatórias sem revestimento epitelial, frequentemente associadas à pancreatite prévia.
Abordagem Diagnóstica Integrada
A investigação das LCPs combina achados de imagem e análise do fluido cístico quando indicada:
- Imagem Seccional (TC e RM/CPRM): A Tomografia Computadorizada (TC) e a Ressonância Magnética (RM), idealmente com Colangiopancreatorressonância (CPRM), constituem os pilares iniciais. Permitem avaliar morfologia (tamanho, localização, uni/multilocularidade, conteúdo micro/macrocístico), características parietais (espessura, calcificações – melhor vistas na TC), presença de septações ou nódulos murais, e comunicação com o sistema ductal pancreático (comunicação e conteúdo interno melhor avaliados pela RM).
- Ultrassonografia Endoscópica (USE): Considerada o método de maior acurácia para a caracterização morfológica detalhada de LCPs, a USE fornece imagens de alta resolução capazes de identificar características sutis como microcistos, espessura da parede, septos finos, pequenos nódulos murais e a relação com o ducto pancreático. Crucialmente, possibilita a Punção Aspirativa por Agulha Fina (PAAF) guiada para coleta de material.
- Análise do Fluido Cístico (obtido por PAAF): A análise bioquímica e citológica do aspirado é uma ferramenta valiosa no diagnóstico diferencial:
- Amilase: Níveis elevados (tipicamente >250 U/L) sugerem comunicação com o sistema ductal, característico de Neoplasias Papilíferas Intraductais Mucinosas (NPIMs) e pseudocistos. Níveis baixos são típicos de Cistoadenomas Serosos (CAS) e Neoplasias Císticas Mucinosas (NCM).
- CEA (Antígeno Carcinoembrionário): Marcador chave para neoplasias mucinosas. Níveis elevados (geralmente >192 ng/mL) são altamente sugestivos de NCM ou NPIM, auxiliando na diferenciação com CAS e pseudocistos (frequentemente <5 ng/mL). Um valor elevado aumenta a suspeita de malignidade e pode influenciar na decisão de ressecção cirúrgica.
- Mucina: A identificação macroscópica ou microscópica de mucina no fluido aponta fortemente para neoplasias mucinosas (NCM ou NPIM).
- Citologia: Pode detectar células atípicas ou malignas, confirmando o diagnóstico de malignidade. Contudo, a sensibilidade é variável e um resultado negativo não exclui malignidade.
- CA 19-9: Embora possa ser dosado no fluido cístico, sua utilidade é considerada inferior à do CEA para o diagnóstico diferencial primário das NCPs.
Caracterização das Principais Neoplasias Císticas Pancreáticas
- Cistoadenoma Seroso (CAS): Entidade tipicamente benigna, mais prevalente em mulheres. Imagem: frequentemente apresenta aspecto microcístico (‘favo de mel’) ou oligocístico; pode ter cicatriz central com calcificação. Fluido: baixa amilase, baixo CEA. O risco de malignização é considerado insignificante.
- Neoplasia Cística Mucinosa (NCM): Possui potencial pré-maligno/maligno, encontrada quase exclusivamente em mulheres, localizada preferencialmente no corpo/cauda pancreática. Imagem: Tipicamente macrocística, unilocular ou multilocular com septos espessos, parede espessa; pode apresentar calcificações periféricas (‘em casca de ovo’). Caracteristicamente, não se comunica com o ducto pancreático principal. Fluido: baixa amilase, alto CEA, presença de mucina.
- Neoplasia Papilífera Intraductal Mucinosa (NPIM): Originária do epitélio ductal, com potencial pré-maligno/maligno. Pode acometer o ducto pancreático principal (MPD), ramos secundários (BD) ou ter padrão misto. Imagem: Dilatação ductal focal ou difusa (MPD >5mm ou BD >1cm) é característica; a comunicação com o sistema ductal é definidora. Pode haver nódulos murais. Fluido: Alta amilase (devido à comunicação ductal), alto CEA, presença de mucina.
- Neoplasia Sólida Pseudopapilar (NSPP) / Tumor de Frantz: Neoplasia rara, predominante em mulheres jovens. Comportamento indolente com baixo potencial de malignidade; prognóstico geralmente favorável após ressecção cirúrgica completa. Imagem: Massa bem definida, encapsulada, heterogênea com componentes sólidos e císticos complexos, frequentemente com áreas de hemorragia e necrose internas. Calcificações podem estar presentes. Histologia: Padrão sólido-pseudopapilar característico, imunorreatividade para beta-catenina.
Indicadores de Risco e Conduta
Achados em exames de imagem considerados de alto risco para malignidade em LCPs, que frequentemente indicam necessidade de investigação anatomopatológica adicional ou ressecção cirúrgica, incluem: diâmetro da lesão superior a 30 mm, presença de componente sólido ou nódulo mural com realce > 5 mm, e dilatação do ducto pancreático principal (Wirsung) associada à lesão (geralmente > 5-10 mm).