O câncer de esôfago representa um desafio oncológico significativo, em parte devido às particularidades anatômicas e fisiopatológicas deste órgão. Compreender a estrutura da parede esofágica, suas vias de drenagem e a ausência de barreiras naturais é fundamental para entender os padrões de disseminação tumoral e as bases do estadiamento e planejamento terapêutico. Este artigo abordará a anatomia do esôfago, a fisiopatologia dos principais tipos histológicos, as vias de disseminação e as complicações associadas, como as fístulas esofágicas.
Anatomia Esofágica e Implicações na Disseminação Tumoral
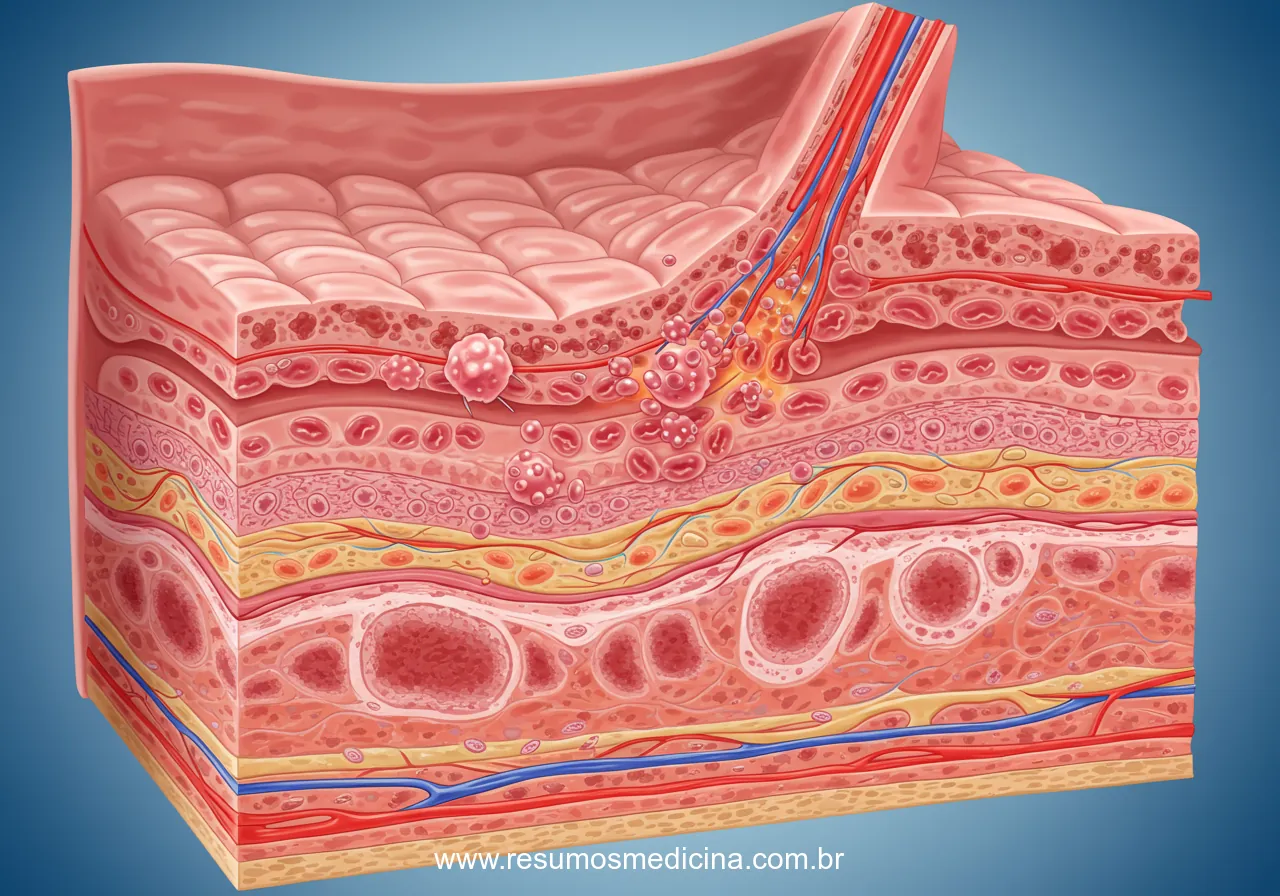
O esôfago é um órgão tubular muscular que estabelece a conexão entre a faringe e o estômago, sendo responsável pela propulsão do bolo alimentar. Sua parede é constituída por quatro camadas concêntricas: mucosa, submucosa, muscular própria e adventícia. A profundidade da invasão tumoral através destas camadas (fator T na classificação TNM) é um determinante crucial do estadiamento e prognóstico no câncer de esôfago.
Uma característica anatômica de grande relevância clínica é a ausência de uma camada serosa na maior parte da extensão torácica do esôfago. Diferentemente de outros órgãos do trato gastrointestinal, onde a serosa atua como uma barreira física limitante, o esôfago é revestido externamente pela adventícia, um tecido conjuntivo frouxo. Esta ausência de barreira anatômica facilita a invasão direta e precoce do tumor para estruturas mediastinais adjacentes.
Principais Vias de Disseminação Influenciadas pela Anatomia
- Invasão Local (Contiguidade): A falta de uma camada serosa permite que as células neoplásicas esofágicas invadam mais facilmente por extensão direta estruturas vizinhas vitais, como a traqueia, os brônquios, a aorta e o pericárdio.
- Disseminação Linfática: A camada submucosa esofágica abriga uma rede linfática extensa e interconectada, com significativa drenagem longitudinal e circunferencial. Esta rica rede facilita a disseminação precoce e ampla das células tumorais para linfonodos regionais (cervicais, mediastinais, abdominais) e a distância. O risco de metástase linfonodal aumenta consideravelmente assim que o tumor invade a submucosa.
- Disseminação Hematogênica: Além das vias de contiguidade e linfática, as células cancerosas podem invadir os vasos sanguíneos da parede esofágica, disseminando-se através da corrente sanguínea para órgãos distantes. Os locais mais comuns de metástases hematogênicas incluem fígado, pulmões e ossos, geralmente ocorrendo em estágios mais avançados da doença.
Em suma, a estrutura anatômica do esôfago, particularmente a ausência de serosa e a presença de uma densa rede linfática submucosa, são fatores preponderantes que favorecem a disseminação tumoral precoce e agressiva, contribuindo para o estadiamento frequentemente avançado e o prognóstico desafiador associado a esta neoplasia.
Tipos Histológicos Predominantes e Suas Localizações Anatômicas Preferenciais
O câncer de esôfago é predominantemente classificado em dois subtipos histológicos principais: o Carcinoma Espinocelular (CEC), também referido como carcinoma de células escamosas ou epidermoide, e o Adenocarcinoma (ADC). A distinção entre estes subtipos é fundamental devido às suas etiologias, localizações anatômicas típicas distintas e implicações prognósticas e terapêuticas.
Carcinoma Espinocelular (CEC)
O CEC origina-se das células do epitélio escamoso estratificado que reveste fisiologicamente a maior parte da mucosa esofágica. Este tipo histológico demonstra uma marcada predileção pelos terços superior e médio do esôfago, com diversas fontes destacando o terço médio como a localização mais frequente. A patogênese envolve dano crônico ao epitélio escamoso, frequentemente associado a fatores de risco específicos, levando a alterações displásicas e subsequente transformação maligna.
Adenocarcinoma (ADC)
O Adenocarcinoma esofágico, por sua vez, desenvolve-se a partir de epitélio glandular metaplásico. Sua ocorrência é quase exclusiva do terço distal do esôfago, particularmente na região da junção esofagogástrica (JEG). A principal condição pré-maligna associada ao ADC é o Esôfago de Barrett (EB).
O Esôfago de Barrett é definido como a substituição do epitélio escamoso estratificado normal do esôfago distal por um epitélio colunar especializado que contém células caliciformes, caracterizando uma metaplasia intestinal. Esta alteração metaplásica representa uma resposta adaptativa da mucosa esofágica à agressão crônica induzida pelo refluxo gastroesofágico (DRGE). A progressão do Esôfago de Barrett para o adenocarcinoma geralmente segue uma sequência histopatológica bem definida: metaplasia → displasia (de baixo grau → alto grau) → adenocarcinoma invasivo. A presença e o grau de displasia no epitélio de Barrett são fatores críticos que aumentam significativamente o risco de malignização.
Portanto, a localização anatômica de um tumor esofágico oferece um forte indicativo do seu provável tipo histológico: tumores situados nos terços superior e médio são majoritariamente CEC, enquanto aqueles localizados no terço inferior e na JEG são predominantemente adenocarcinomas, quase invariavelmente associados à presença de Esôfago de Barrett preexistente.
Fisiopatologia do CEC
O Carcinoma Espinocelular (CEC), ou carcinoma de células escamosas, origina-se do epitélio escamoso estratificado que naturalmente reveste o esôfago. Sua patogênese é um processo multifatorial complexo, iniciado pela exposição prolongada a agentes agressores específicos que causam dano celular crônico e inflamação persistente na mucosa esofágica. Esta agressão contínua induz alterações genéticas e epigenéticas progressivas, levando ao desenvolvimento de lesões displásicas precursoras. A sequência patogenética clássica envolve o dano epitelial repetido, seguido pelo surgimento de displasia (de baixo e alto grau) e, subsequentemente, pela transformação maligna com proliferação celular descontrolada e desenvolvimento de carcinoma invasivo. A invasão da parede esofágica e de estruturas adjacentes, como a árvore traqueobrônquica, é uma consequência desta progressão.
Fatores de Risco e Mecanismos Etiopatogênicos Associados ao CEC
A etiologia do CEC está associada a diversos fatores de risco bem definidos, cujos mecanismos contribuem para o processo carcinogênico:
- Tabagismo e Alcoolismo: Constituem os fatores de risco mais significativos. O tabaco contém carcinógenos que causam dano direto ao DNA das células epiteliais esofágicas, promovendo mutações oncogênicas. O álcool, além de causar irritação e inflamação crônica na mucosa, atua como solvente, facilitando a penetração celular de outros carcinógenos. O consumo combinado de tabaco e álcool demonstra um efeito sinérgico, multiplicando o risco de desenvolvimento de CEC.
- Acalasia: Este distúrbio motor esofágico, caracterizado pela aperistalse do corpo esofágico e relaxamento inadequado do esfíncter esofágico inferior, resulta em estase alimentar crônica. A retenção prolongada de alimentos e secreções no lúmen esofágico induz inflamação crônica da mucosa (esofagite de estase), um ambiente propício para a transformação neoplásica escamosa.
- Lesões Cáusticas (Esofagite Cáustica): A ingestão de substâncias cáusticas provoca necrose tecidual, inflamação aguda e, subsequentemente, um processo de cicatrização que frequentemente resulta em fibrose e estenoses. A inflamação crônica persistente e a regeneração celular contínua e potencialmente descontrolada na área lesionada aumentam significativamente o risco de desenvolvimento de CEC a longo prazo, muitas vezes décadas após a exposição inicial.
- Síndrome de Plummer-Vinson (Paterson-Kelly): Caracterizada pela tríade de disfagia (associada a membranas esofágicas, tipicamente na região cervical), anemia ferropriva e glossite atrófica. Esta síndrome é um fator de risco estabelecido para o desenvolvimento de CEC, particularmente na hipofaringe e no esôfago proximal.
- Tilose Palmar e Plantar (Tilose Esofágica): Uma condição genética rara, autossômica dominante, associada a hiperceratose palmoplantar. A variante específica conhecida como Tilose com Câncer Esofágico (TOC – Tylosis with Esophageal Cancer) confere um risco extremamente elevado para o desenvolvimento de CEC, frequentemente manifestando-se em indivíduos jovens (antes dos 40 anos).
- Dieta: Dietas com baixo consumo de frutas e vegetais frescos têm sido associadas a um risco aumentado, possivelmente devido à deficiência de micronutrientes e antioxidantes essenciais para a proteção e reparo celular.
A identificação e a compreensão dos mecanismos pelos quais esses fatores de risco contribuem para a patogênese do CEC são essenciais para estratégias de prevenção primária, rastreamento em populações de alto risco e vigilância adequada.
Fisiopatologia do Adenocarcinoma Esofágico
O adenocarcinoma esofágico (ADC) tem sua gênese primariamente associada às consequências da Doença do Refluxo Gastroesofágico (DRGE) crônica. A exposição prolongada e repetida do epitélio esofágico distal ao refluxo de conteúdo gástrico, notadamente ácido clorídrico e sais biliares, induz um estado de inflamação crônica (esofagite de refluxo) e lesão tecidual persistente.
Esôfago de Barrett como Lesão Precursora
Como uma resposta adaptativa a essa agressão química crônica, o epitélio escamoso estratificado nativo do esôfago distal pode ser substituído por um epitélio colunar especializado com características de metaplasia intestinal, contendo células caliciformes. Esta condição, denominada Esôfago de Barrett, representa a principal lesão pré-maligna para o ADC. Embora seja um mecanismo adaptativo à exposição ácida, o epitélio metaplásico é inerentemente mais suscetível à transformação neoplásica.
Sequência Metaplasia-Displasia-Carcinoma
A progressão do Esôfago de Barrett para o adenocarcinoma invasivo segue uma sequência histopatológica e molecular bem definida:
- Metaplasia: Induzida pela DRGE crônica, como descrito acima.
- Displasia: A inflamação crônica persistente no epitélio metaplásico pode promover instabilidade genética e alterações epigenéticas, culminando no desenvolvimento de displasia. A displasia é caracterizada por uma proliferação neoplásica confinada ao epitélio, com alterações citológicas e arquiteturais. É graduada histologicamente em displasia de baixo grau e displasia de alto grau, com base na severidade dessas alterações.
- Adenocarcinoma Invasivo: A displasia de alto grau é considerada o precursor imediato do adenocarcinoma, representando um estágio onde as células neoplásicas possuem alto potencial para romper a membrana basal e invadir a submucosa e camadas mais profundas.
O risco de progressão para adenocarcinoma é diretamente influenciado pela extensão longitudinal do segmento de Esôfago de Barrett e, de forma crucial, pela presença e pelo grau da displasia identificada nas amostras biopsiadas.
Fatores de Risco Associados
Além da DRGE e do Esôfago de Barrett, outros fatores de risco contribuem para o desenvolvimento do ADC, incluindo:
- Obesidade: Particularmente a obesidade central (abdominal), está fortemente associada ao aumento do risco de ADC, possivelmente por mecanismos relacionados ao aumento da pressão intra-abdominal, maior prevalência de DRGE e fatores hormonais/inflamatórios associados à adiposidade. O aumento na incidência global de obesidade tem sido correlacionado com o aumento na incidência de ADC esofágico.
- Sexo Masculino: Homens apresentam maior risco de desenvolver ADC em comparação às mulheres.
- Idade Avançada: O risco aumenta progressivamente com a idade.
- Etnia Caucasiana: Indivíduos caucasianos apresentam maior incidência em comparação a outros grupos étnicos.
Implicações para Vigilância
O entendimento da sequência metaplasia-displasia-carcinoma fundamenta a prática clínica de vigilância endoscópica periódica em pacientes diagnosticados com Esôfago de Barrett. Através de endoscopia digestiva alta com protocolos de biópsias seriadas, busca-se a detecção precoce de displasia (especialmente de alto grau) ou de adenocarcinoma em estágio inicial, permitindo a aplicação de estratégias terapêuticas com potencial curativo, como a ressecção endoscópica ou ablação.
Vias de Disseminação
A progressão do câncer de esôfago para além do sítio primário ocorre fundamentalmente por três vias principais: invasão local direta (contiguidade), disseminação linfática e disseminação hematogênica. As características anatômicas do esôfago, como a ausência de serosa e a presença de uma rica rede linfática submucosa (discutidas anteriormente), influenciam significativamente a facilidade e os padrões dessas vias de disseminação.
Disseminação por Contiguidade
A ausência de uma barreira serosa facilita a invasão direta de estruturas adjacentes pelo tumor primário. Órgãos e tecidos comumente afetados por contiguidade incluem a árvore traqueobrônquica (traqueia e brônquios), a aorta, o pericárdio e o nervo laríngeo recorrente. A invasão da árvore traqueobrônquica, particularmente por tumores localizados nos terços médio ou superior do esôfago, pode resultar na formação de fístulas esofagotraqueais ou esofagobrônquicas. Essas fístulas representam complicações graves, permitindo a passagem de conteúdo esofágico para as vias aéreas, o que pode levar a tosse durante a deglutição, pneumonias aspirativas de repetição e insuficiência respiratória. A broncoscopia é uma ferramenta diagnóstica essencial na avaliação da suspeita de invasão traqueobrônquica ou na confirmação de fístulas. A invasão do nervo laríngeo recorrente pode manifestar-se clinicamente como rouquidão, indicando extensão tumoral local avançada.
Disseminação Linfática
A extensa rede linfática intramural (submucosa) e extramural do esôfago, com drenagem longitudinal e circunferencial, propicia a disseminação linfática precoce e frequente. O risco de metástases linfonodais aumenta com a profundidade da invasão tumoral na parede esofágica, especialmente ao atingir a submucosa. As células neoplásicas podem disseminar-se para múltiplos níveis de linfonodos regionais, incluindo cadeias cervicais, mediastinais e abdominais. A disseminação linfática é um fator prognóstico adverso crucial e determinante no estadiamento. Sinais clínicos de disseminação linfática avançada podem incluir o linfonodo de Virchow (linfonodo supraclavicular esquerdo aumentado, indicativo de metástase de neoplasias torácicas ou abdominais) e a prateleira de Blumer (metástase peritoneal no fundo de saco de Douglas, detectável ao toque retal ou vaginal).
Disseminação Hematogênica
A disseminação hematogênica, ocorrida pela invasão de vasos sanguíneos pelas células tumorais e seu transporte pela circulação sistêmica, geralmente caracteriza estágios mais avançados da doença. Os sítios mais comuns de metástases à distância por via hematogênica no câncer de esôfago incluem o fígado, os pulmões, os ossos e as glândulas adrenais. A presença de metástases à distância (M1 na classificação TNM) classifica a doença como estágio IV, impactando significativamente as opções terapêuticas e o prognóstico.
Manifestações Clínicas
As manifestações clínicas do câncer de esôfago frequentemente emergem em estágios mais avançados, refletindo o crescimento tumoral intraluminal, a obstrução progressiva e a invasão de estruturas adjacentes. A identificação destes sinais e sintomas é fundamental para o diagnóstico e estadiamento.
Disfagia Progressiva
A disfagia, ou dificuldade para deglutir, representa o sintoma mais prevalente e característico. Geralmente de instalação insidiosa, caracteriza-se pela progressão: inicia-se com dificuldade para alimentos sólidos, evoluindo para consistências pastosas e, por fim, líquidos, à medida que o crescimento tumoral oblitera o lúmen esofágico. A fisiopatologia subjacente é a obstrução mecânica. A velocidade desta progressão pode variar dependendo do tipo histológico do tumor, sua localização específica e a resposta biológica individual. A presença de disfagia persistente e progressiva exige investigação imediata para descartar malignidade esofágica.
Perda Ponderal
A perda de peso involuntária significativa é uma manifestação comum e um marcador de prognóstico adverso. Sua etiologia é multifatorial, resultante da redução da ingesta calórica devido à disfagia e odinofagia, associada ao estado hipercatabólico induzido pela própria neoplasia (caquexia neoplásica). A avaliação do estado nutricional e a instituição de suporte nutricional adequado são componentes críticos do manejo, influenciando a tolerância e a resposta ao tratamento oncológico.
Rouquidão (Disfonia)
A rouquidão persistente pode sinalizar doença localmente avançada, particularmente em tumores localizados nos segmentos esofágicos superior e médio. Esta manifestação tipicamente decorre da invasão ou compressão do nervo laríngeo recorrente (esquerdo mais frequentemente) pelo tumor primário ou por linfonodos mediastinais metastáticos. A paralisia da corda vocal resultante leva à alteração da qualidade vocal. Sua presença implica necessidade de investigação para avaliar a extensão da doença e o envolvimento nervoso.
Tosse e Complicações Respiratórias Associadas à Fístula Esofagorrespiratória
A presença de tosse, especialmente desencadeada pela deglutição (sobretudo de líquidos), é um sinal de alarme para a formação de uma fístula esofagorrespiratória (traqueoesofágica ou broncoesofágica). Esta complicação grave, resultado da invasão local por contiguidade, manifesta-se clinicamente pela aspiração de conteúdo esofágico para as vias aéreas. As consequências clínicas incluem pneumonias aspirativas de repetição, dispneia, episódios de sufocação, estridor (menos comum) e, em casos avançados, insuficiência respiratória. A presença de uma fístula indica doença avançada e requer manejo específico.
Sinais de Doença Avançada e Metastática
Além dos sintomas primários, sinais clínicos específicos podem indicar disseminação avançada do câncer de esôfago:
- Linfonodo de Virchow: A palpação de um linfonodo supraclavicular esquerdo endurecido e aumentado pode representar metástase linfática à distância.
- Prateleira de Blumer: Em casos de disseminação peritoneal, pode ser identificada uma massa endurecida no fundo de saco de Douglas (retovesical ou retouterino) através do toque retal ou vaginal, correspondendo à metástase tumoral.
A identificação destes achados é crucial para o estadiamento preciso e definição da estratégia terapêutica, frequentemente indicando doença metastática (Estágio IV).
Fístulas Esofagorrespiratórias
As fístulas esofagorrespiratórias são comunicações anormais estabelecidas entre o lúmen do esôfago e as vias aéreas, abrangendo a traqueia (fístula traqueoesofágica – FTE) ou os brônquios (fístula broncoesofágica). Estas representam uma complicação grave e de prognóstico reservado, frequentemente associada ao câncer de esôfago em estágio avançado, resultando em morbidade significativa.
Etiologia e Fisiopatologia
No contexto oncológico, a principal causa de fístulas esofagorrespiratórias adquiridas em adultos é a malignidade. A formação da fístula decorre tipicamente da invasão tumoral direta, seguida de necrose, das paredes esofágica e traqueal ou brônquica adjacentes. Carcinomas esofágicos avançados, notadamente aqueles localizados nos terços médio ou superior, apresentam maior propensão a essa complicação. Outras etiologias, menos comuns neste cenário, incluem complicações pós-cirúrgicas, pós-radioterapia, infecções ou trauma.
Manifestações Clínicas Indicativas
A apresentação clínica é uma consequência direta da passagem de conteúdo digestivo para a árvore respiratória. O sintoma mais patognomônico é a tosse intensa que ocorre imediatamente após a deglutição, particularmente de líquidos (sinal de Ohngren). Outras manifestações incluem episódios recorrentes de pneumonia aspirativa, dispneia, estridor e, em casos graves, insuficiência respiratória. A aspiração crônica agrava o estado nutricional e clínico do paciente.
Diagnóstico
A investigação diagnóstica diante da suspeita clínica de fístula esofagorrespiratória combina métodos de imagem e endoscopia:
- Esofagograma Contrastado: Utiliza contraste de bário ou hidrossolúvel para opacificar o esôfago. A visualização do meio de contraste no interior da árvore traqueobrônquica confirma a presença da fístula. Manobras específicas, como a realização do exame em decúbito ventral e com compressão abdominal, podem aumentar a sensibilidade na detecção de fístulas pequenas.
- Broncoscopia: Permite a visualização direta do orifício fistuloso na parede da traqueia ou brônquio. É essencial para avaliar a localização exata, o tamanho da comunicação, a integridade das vias aéreas e a extensão da invasão neoplásica adjacente. Biópsias podem ser coletadas se houver suspeita de malignidade associada ou para confirmação etiológica.
Manejo Terapêutico Paliativo
O tratamento das fístulas esofagorrespiratórias de etiologia maligna é predominantemente paliativo. Os objetivos principais são o controle dos sintomas respiratórios, a prevenção da aspiração pulmonar e a melhoria da qualidade de vida, permitindo, quando possível, a retomada da via oral. A escolha da estratégia depende da localização e tamanho da fístula, da condição clínica do paciente e da extensão da doença oncológica.
- Tratamento Endoscópico: A colocação de próteses esofágicas autoexpansíveis (stents), preferencialmente revestidas para promover a selagem, é a abordagem mais comum e eficaz. O stent atua como uma barreira física, ocluindo o pertuito fistuloso no lado esofágico e desviando o fluxo alimentar, o que previne a aspiração e alivia a tosse, possibilitando a deglutição. Cílios endoscópicos podem ser considerados em casos selecionados de fístulas pequenas. Se houver comprometimento significativo da via aérea por compressão ou invasão tumoral, a colocação de próteses traqueobrônquicas pode ser necessária.
- Tratamento Conservador e de Suporte: Medidas de suporte são fundamentais e incluem a otimização do estado nutricional (frequentemente requerendo nutrição enteral por sonda ou nutrição parenteral), manejo de secreções brônquicas com aspiração frequente e antibioticoterapia para tratar ou prevenir pneumonias aspirativas.
- Outras Abordagens: Intervenções cirúrgicas, como a exclusão esofágica ou a confecção de gastrostomia ou jejunostomia para alimentação enteral definitiva, são geralmente reservadas para casos de exceção devido à alta morbimortalidade em pacientes debilitados com doença avançada. A radioterapia pode ser empregada com intenção paliativa para controle tumoral locorregional, mas não é considerada um tratamento primário para o fechamento da fístula, embora possa, eventualmente, reduzir o débito fistuloso pelo controle da neoplasia.
Complicações do Tratamento Endoscópico
A colocação de stents esofágicos, apesar de eficaz, não é isenta de riscos. As complicações potenciais incluem dor torácica persistente, migração proximal ou distal do stent, impactação alimentar acima do stent, hemorragia, perfuração esofágica durante o procedimento, o desenvolvimento de novas fístulas e o crescimento tumoral através das malhas do stent (ingrowth) ou além de suas extremidades (overgrowth). O manejo adequado destas complicações pode exigir reintervenções endoscópicas ou, mais raramente, abordagens cirúrgicas.
Manejo da Disfagia e Suporte Nutricional no Câncer de Esôfago
A disfagia é uma manifestação clínica frequente e debilitante em pacientes com câncer de esôfago, resultante do estreitamento luminal progressivo causado pelo crescimento tumoral. Seu manejo adequado é crucial, pois impacta diretamente a capacidade de ingestão alimentar e o estado nutricional, fatores com implicações prognósticas significativas e na tolerância aos tratamentos oncológicos.
Abordagens Paliativas para a Disfagia Severa
Em casos de doença avançada com disfagia significativa, o objetivo terapêutico principal é a paliação, visando restaurar a capacidade de deglutição e melhorar a qualidade de vida. As estratégias de desobstrução incluem:
- Dilatação Esofágica: Utilização endoscópica de balões ou sondas para alargar mecanicamente a estenose tumoral.
- Colocação de Próteses Esofágicas (Stents): Implantação de dispositivos, como stents metálicos autoexpansíveis (SEMS) ou plásticos, para manter a perviedade do lúmen esofágico. É uma opção minimamente invasiva e eficaz na maioria dos casos.
- Terapia Fotodinâmica: Aplicação de um agente fotossensibilizador ativado por laser para induzir necrose tumoral, reservada para casos selecionados.
A escolha da técnica paliativa é individualizada, baseada na localização e extensão do tumor, condições clínicas do paciente e recursos disponíveis.
Complicações Associadas às Próteses Esofágicas
A utilização de próteses esofágicas, embora eficaz, não é isenta de complicações potenciais, que requerem reconhecimento e manejo apropriados. As principais incluem:
- Dor torácica
- Migração ou deslocamento da prótese
- Impactação alimentar
- Hemorragia digestiva
- Perfuração esofágica (iatrogênica ou tardia)
- Crescimento tumoral através ou nas extremidades da prótese (ingrowth/overgrowth)
- Desenvolvimento de novas fístulas esofágicas
O manejo dessas complicações pode necessitar de intervenções endoscópicas ou, mais raramente, cirúrgicas adicionais.
Importância do Suporte Nutricional
O estado nutricional é um fator determinante no prognóstico e na capacidade do paciente de tolerar as modalidades terapêuticas (cirurgia, quimioterapia, radioterapia). A disfagia frequentemente leva a uma redução severa da ingesta calórico-proteica, perda de peso expressiva e desnutrição, comprometendo os resultados clínicos.
Uma avaliação nutricional detalhada e periódica é mandatória. O suporte nutricional especializado deve ser instituído precocemente quando a via oral é insuficiente. As opções incluem:
- Nutrição Enteral (NE): Preferencial quando o trato gastrointestinal está funcionante. Pode ser administrada via suplementos orais, sondas nasoenterais ou por acessos enterais de longa permanência como gastrostomia ou jejunostomia. Estas últimas são alternativas essenciais quando a via oral ou a desobstrução endoscópica não são suficientes ou viáveis.
- Nutrição Parenteral (NP): Indicada quando o trato gastrointestinal não pode ser utilizado, sendo administrada por via intravenosa.
A otimização do estado nutricional é fundamental para melhorar a tolerância ao tratamento, reduzir o risco de complicações, potencialmente aumentar a eficácia terapêutica e preservar a qualidade de vida.