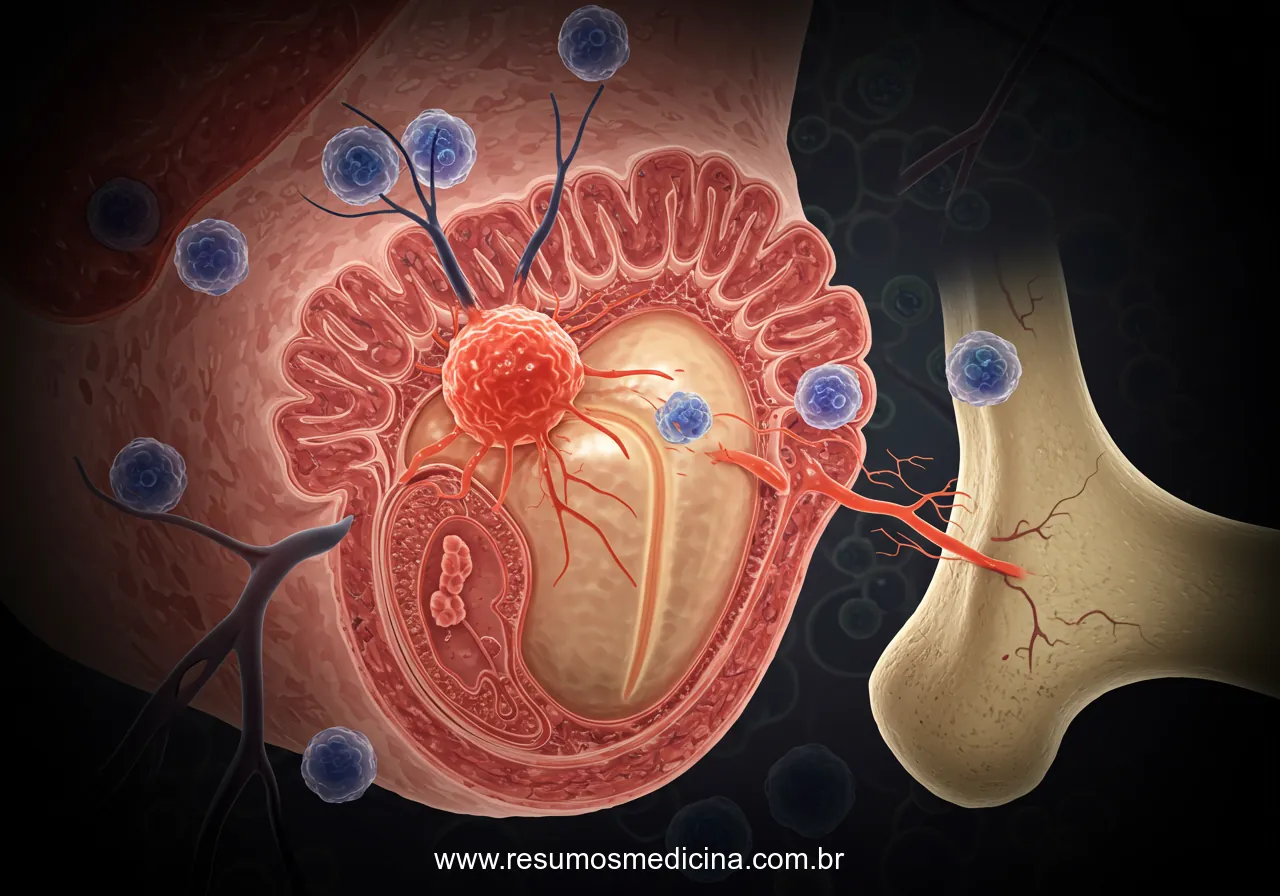
O câncer de próstata avançado e metastático representa uma fase da doença caracterizada pela disseminação para além da glândula prostática, frequentemente envolvendo sítios como os ossos (particularmente coluna vertebral e pelve) e linfonodos, ou apresentando significativa extensão local. Nesta conjuntura, o tratamento sistêmico torna-se a pedra angular da abordagem terapêutica, dada a natureza disseminada da neoplasia.
Abordagem Terapêutica no Câncer de Próstata Avançado e Metastático: Objetivos e Modalidades
O manejo do câncer de próstata avançado/metastático visa primariamente controlar a progressão tumoral, aliviar os sintomas associados – como dor óssea, fraturas patológicas e potencial compressão medular decorrentes de metástases ósseas (sítio mais comum) – melhorar ou manter a qualidade de vida do paciente e prolongar a sobrevida. A escolha e o sequenciamento das terapias são individualizados, considerando fatores como a extensão da doença, o estado geral de saúde do paciente, a resposta a tratamentos prévios e as características histopatológicas e moleculares do tumor.
Principais Modalidades Terapêuticas
O arsenal terapêutico para o câncer de próstata avançado/metastático é diversificado, incluindo:
- Terapia de Deprivação Androgênica (TDA) / Terapia de Privação Androgênica (TPA): Considerada a terapia de primeira linha, foca na redução drástica dos níveis de andrógenos, principalmente testosterona, que estimulam o crescimento das células neoplásicas. Pode ser alcançada cirurgicamente (orquiectomia bilateral) ou farmacologicamente (uso de análogos – agonistas ou antagonistas – do LHRH/GnRH, e/ou antiandrogênicos).
- Novas Terapias Hormonais: Agentes como abiraterona e enzalutamida atuam em pontos específicos da via de sinalização androgênica, sendo cruciais no tratamento do Câncer de Próstata Resistente à Castração (CPRC), estágio em que o tumor progride apesar da TDA.
- Quimioterapia Citotóxica: Utilizada tipicamente após falha da TDA (CPRC) ou em casos de doença metastática de alto volume/agressividade ao diagnóstico. Docetaxel e cabazitaxel são os agentes mais comuns nesse cenário.
- Radiofármacos e Terapias Ósseas Direcionadas: Incluem agentes como rádio-223 (em CPRC com metástases ósseas sintomáticas) e medicamentos como bifosfonatos ou denosumabe para manejo de complicações ósseas.
- Radioterapia Externa: Empregada principalmente com intenção paliativa para controle de sintomas localizados, especialmente dor óssea.
- Outras Opções: Imunoterapia (como sipuleucel-T) e terapias-alvo podem ser consideradas em contextos clínicos específicos.
A gestão do câncer de próstata avançado envolve frequentemente a combinação ou sequenciamento destas modalidades, adaptando-se à evolução da doença e à resposta individual do paciente, com destaque para o desenvolvimento de resistência à castração (CPRC) como um ponto de inflexão terapêutica.
Terapia de Deprivação Androgênica (TDA/TPA): Mecanismos e Modalidades Terapêuticas
A Terapia de Deprivação Androgênica (TDA), também conhecida como Terapia de Privação Androgênica (TPA) ou bloqueio androgênico, fundamenta-se na redução dos níveis ou do efeito dos andrógenos, principalmente a testosterona, que impulsionam o crescimento das células do câncer de próstata. Diversas estratégias são empregadas para alcançar este objetivo, atuando em diferentes pontos do eixo hormonal.
Modalidades de TDA/TPA
As principais abordagens para induzir a deprivação androgênica incluem:
Orquiectomia Bilateral
Este procedimento cirúrgico consiste na remoção de ambos os testículos, que são a principal fonte de produção de testosterona. Caracteriza-se por ser uma modalidade de TDA eficaz, permanente e que promove uma rápida redução dos níveis séricos de testosterona para a faixa de castração. Aspectos psicossociais e a irreversibilidade devem ser considerados na decisão terapêutica.
Terapias Farmacológicas
Alternativas não cirúrgicas e reversíveis à orquiectomia visam suprimir a produção de testosterona ou bloquear sua ação a nível celular:
- Análogos/Agonistas do LHRH (Hormônio Liberador de Hormônio Luteinizante) / GnRH (Hormônio Liberador de Gonadotrofinas): Estes fármacos atuam sobre os receptores de LHRH na glândula pituitária (hipófise). O uso contínuo provoca uma dessensibilização (downregulation) destes receptores, suprimindo a secreção de Hormônio Luteinizante (LH). A redução do LH interrompe o estímulo para a produção de testosterona pelos testículos, resultando em níveis hormonais próximos aos obtidos com a castração cirúrgica. A administração é tipicamente parenteral (subcutânea ou intramuscular) em intervalos regulares. Uma elevação transitória inicial de testosterona (‘flare’) pode ocorrer antes da supressão.
- Antagonistas do LHRH/GnRH: Estes agentes ligam-se competitivamente aos receptores de GnRH na hipófise, bloqueando imediatamente a liberação de LH e FSH. Consequentemente, induzem uma supressão rápida dos níveis de testosterona, sem o fenômeno de ‘flare’ inicial observado com os agonistas. Constituem uma alternativa farmacológica direta para a supressão androgênica central.
- Antiandrogênicos: Diferentemente das estratégias anteriores que focam na redução da produção de testosterona testicular, os antiandrogênicos atuam bloqueando a ligação dos andrógenos (como a testosterona e a diidrotestosterona) aos seus receptores (Receptor Androgênico – RA) presentes nas células tumorais prostáticas. Ao impedir essa ligação, bloqueiam a sinalização intracelular que promove a proliferação celular. Podem ser utilizados em combinação com análogos/antagonistas de LHRH ou em outras linhas de tratamento.
Efeitos Adversos Comuns da TDA/TPA
A supressão androgênica sistêmica, embora eficaz no controle tumoral, está associada a um perfil característico de efeitos adversos que demandam monitoramento e manejo clínico. Os principais incluem:
- Sintomas vasomotores (fogachos)
- Ginecomastia e sensibilidade mamária
- Disfunção sexual (redução da libido, disfunção erétil)
- Alterações metabólicas (ganho de peso, alterações no perfil lipídico, resistência à insulina, configurando síndrome metabólica)
- Perda de massa muscular e óssea (osteopenia/osteoporose), aumentando o risco de fraturas patológicas
- Fadiga
- Potencial aumento do risco cardiovascular
- Alterações de humor e cognitivas
A escolha da modalidade de TDA deve ser individualizada, levando em conta a eficácia, perfil de efeitos colaterais, via de administração, reversibilidade, custo e as preferências do paciente.
Metástases no Câncer de Próstata: Sítios Comuns, Patogênese e Implicações Clínicas
A progressão do câncer de próstata frequentemente envolve a disseminação de células neoplásicas para sítios distantes da glândula prostática, caracterizando a doença metastática. Essa disseminação pode ocorrer através de diferentes vias, incluindo hematogênica, linfática ou por extensão direta aos tecidos adjacentes.
Vias de Disseminação e Sítios Metastáticos Prevalentes
A via hematogênica é um mecanismo crucial para a disseminação sistêmica. O tecido ósseo representa o sítio metastático mais comum para o câncer de próstata, exibindo uma marcada predileção pelo esqueleto axial, notadamente a coluna vertebral e a pelve. Os linfonodos regionais constituem o segundo local mais frequente de metástases. Manifestações em órgãos viscerais, como pulmões e fígado, são observadas com menor frequência.
Patogênese e Características das Metástases Ósseas
A colonização óssea pelas células do câncer de próstata ocorre predominantemente por meio das vias sanguínea e linfática. Uma característica histopatológica distintiva é a natureza predominantemente osteoblástica das lesões metastáticas, que induzem a formação de novo tecido ósseo reacional. No entanto, é relevante notar que um componente osteolítico pode coexistir. A cintilografia óssea é uma ferramenta de imagem frequentemente empregada para a detecção dessas metástases.
Manifestações Clínicas e Implicações Prognósticas
As manifestações clínicas das metástases são diversas. A dor óssea é a apresentação sintomática mais prevalente, embora um número significativo de pacientes possa permanecer assintomático, com as metástases sendo identificadas incidentalmente em exames de imagem. Complicações graves associadas às metástases ósseas incluem fraturas patológicas, compressão da medula espinhal (uma emergência oncológica) e hipercalcemia. O manejo dessas implicações frequentemente requer abordagens multimodais, incluindo analgesia, radioterapia paliativa e o uso de agentes modificadores do osso, como bifosfonatos ou denosumabe, para reduzir o risco de eventos esqueléticos relacionados. A presença de doença metastática, independentemente do sítio, classifica o câncer de próstata como avançado e está inequivocamente associada a um prognóstico menos favorável.
Metástases em Sítios Menos Comuns: Sistema Nervoso Central
Embora consideravelmente menos frequente que as metástases ósseas ou linfonodais, o câncer de próstata pode metastatizar para o sistema nervoso central (SNC). A investigação diagnóstica de metástases no SNC, utilizando métodos como tomografia computadorizada (TC) ou ressonância magnética (RM) do crânio, geralmente não é indicada de forma rotineira. Esta investigação é reservada para pacientes que desenvolvem sintomatologia neurológica sugestiva de acometimento central.
Manejo Específico das Metástases Ósseas no Câncer de Próstata
A presença de metástases ósseas no câncer de próstata impõe desafios clínicos significativos, demandando estratégias de manejo direcionadas para mitigar complicações que impactam diretamente a funcionalidade e a qualidade de vida do paciente.
Principais Complicações Clínicas
As complicações resultantes do acometimento ósseo metastático requerem vigilância e intervenção ativa:
- Dor Óssea: A manifestação sintomática mais prevalente, frequentemente necessitando de abordagem analgésica escalonada.
- Fraturas Patológicas: Resultantes da fragilidade óssea induzida pela infiltração tumoral, aumentando a morbidade e a necessidade de intervenções ortopédicas.
- Compressão da Medula Espinhal: Uma emergência oncológica decorrente de metástases vertebrais, com risco de déficits neurológicos irreversíveis se não tratada prontamente.
- Hipercalcemia: Embora menos comum no câncer de próstata comparado a outros tumores com metástases ósseas, pode ocorrer devido à lise óssea induzida pelo tumor.
Estratégias Terapêuticas para o Manejo das Metástases Ósseas
O manejo visa aliviar sintomas, prevenir eventos esqueléticos e controlar a progressão local da doença no osso. As principais abordagens incluem:
- Controle da Dor: A utilização sistemática de analgésicos, frequentemente seguindo a escada analgésica da Organização Mundial da Saúde (OMS), é essencial.
- Agentes Modificadores Ósseos (Bone-Targeting Agents – BTAs): Fármacos como os **bifosfonatos** e o **denosumabe** (um anticorpo monoclonal inibidor de RANKL) são fundamentais. Atuam inibindo a atividade osteoclástica, reduzindo a reabsorção óssea, aliviando a dor e diminuindo o risco de eventos relacionados ao esqueleto (SREs), como fraturas patológicas e a necessidade de radioterapia ou cirurgia óssea.
- Radioterapia Externa Paliativa: Direcionada a sítios específicos de metástases ósseas sintomáticas, é altamente eficaz no alívio da dor localizada. Também desempenha um papel crucial no tratamento de emergências como a compressão medular.
- Radiofármacos: O **Rádio-223 (Ra-223)**, um emissor de partículas alfa, é uma opção terapêutica para pacientes com câncer de próstata resistente à castração (CPRC) com metástases ósseas sintomáticas e sem metástases viscerais conhecidas. Ele se direciona preferencialmente às áreas de alta remodelação óssea (metástases osteoblásticas), entregando radiação citotóxica diretamente às células tumorais no microambiente ósseo.
A seleção e a sequência dessas estratégias terapêuticas devem ser individualizadas, baseadas na extensão da doença óssea, na intensidade dos sintomas, no status de resistência à castração, no estado geral do paciente e nos tratamentos prévios. Um manejo proativo e multidisciplinar é crucial para otimizar os desfechos, preservando a qualidade de vida e a funcionalidade dos pacientes com câncer de próstata metastático para os ossos.
Desenvolvimento de Resistência à Castração (CPRC): Definição e Mecanismos Subjacentes
Apesar da resposta inicial frequentemente observada com a Terapia de Deprivação Androgênica (TDA/TPA), um marco evolutivo comum no câncer de próstata avançado é o desenvolvimento de resistência a este tratamento. Este fenômeno clínico define o Câncer de Próstata Resistente à Castração (CPRC), caracterizado pela progressão da doença – seja ela clínica, bioquímica ou radiológica – a despeito da manutenção de níveis séricos de testosterona em faixa de castração, resultado da TDA continuada. Nesta fase, o tumor demonstra capacidade de proliferação e crescimento mesmo em um ambiente de baixa concentração androgênica.
Mecanismos Biológicos da Resistência à Castração
A transição para o estado de CPRC é mediada por mecanismos biológicos adaptativos complexos, que conferem às células tumorais a capacidade de sobreviver e proliferar sob deprivação androgênica. A identificação e compreensão destes mecanismos são essenciais para o desenvolvimento de estratégias terapêuticas eficazes para o CPRC. Os mecanismos predominantes incluem:
- Superexpressão do Receptor de Andrógeno (RA): O aumento da expressão do gene do RA leva a níveis elevados da proteína RA na célula tumoral, amplificando a resposta a quantidades mínimas de andrógenos circulantes ou intratumorais.
- Mutações no Gene do Receptor de Andrógeno: Alterações na sequência do gene do RA podem resultar em um receptor constitutivamente ativo (independente de ligante), ou que pode ser ativado por outros esteroides (promiscuidade do receptor) ou até mesmo por antiandrogênicos (ativação paradoxal).
- Produção Intratumoral de Andrógenos: As células cancerígenas prostáticas podem adquirir a capacidade de sintetizar seus próprios andrógenos (como testosterona e di-hidrotestosterona) a partir de precursores (ex: colesterol ou andrógenos adrenais), mantendo a sinalização via RA de forma autócrina ou parácrina.
- Ativação de Vias de Sinalização Alternativas (‘Bypass Pathways’): O tumor pode ativar vias de sinalização oncogênicas que contornam a dependência direta do eixo RA, promovendo crescimento e sobrevivência celular através de outros mecanismos moleculares, como os mediados por fatores de crescimento ou outras quinases.
O conhecimento detalhado destas vias de resistência molecular permite a aplicação racional de terapias subsequentes direcionadas especificamente aos desafios impostos pelo CPRC.
Estratégias Terapêuticas no Câncer de Próstata Resistente à Castração (CPRC)
Uma vez estabelecido o estado de Câncer de Próstata Resistente à Castração (CPRC), onde ocorre progressão da doença apesar da terapia de deprivação androgênica (TDA) convencional, a abordagem terapêutica se desloca para estratégias sistêmicas subsequentes. O objetivo principal é controlar a progressão tumoral, aliviar sintomas associados e prolongar a sobrevida.
O manejo do CPRC envolve diversas modalidades terapêuticas aprovadas e estabelecidas, cuja seleção e sequenciamento são baseados em múltiplos fatores. As principais opções incluem:
- Terapias Hormonais de Segunda Geração (Novas Terapias Hormonais): Estes fármacos atuam por diferentes mecanismos para inibir a via de sinalização do receptor de andrógeno (RA) de forma mais potente ou abrangente que a TDA tradicional, sendo eficazes mesmo em ambiente de castração. Incluem:
- Inibidores da síntese de andrógenos (ex: Abiraterona, que inibe a enzima CYP17).
- Inibidores potentes do receptor de andrógeno (ex: Enzalutamida, Apalutamida), que bloqueiam múltiplas etapas da sinalização via RA.
- Quimioterapia Citotóxica: Agentes quimioterápicos são opções importantes, particularmente em doença sintomática, rapidamente progressiva ou com presença de metástases viscerais. Os regimes com benefício de sobrevida comprovado no CPRC incluem:
- Docetaxel, frequentemente a primeira opção de quimioterapia neste cenário.
- Cabazitaxel, um taxano de segunda geração, eficaz em pacientes cuja doença progrediu durante ou após o tratamento com docetaxel.
- Outras Modalidades Terapêuticas Direcionadas: Opções adicionais podem ser consideradas em contextos clínicos e moleculares específicos:
- Imunoterapia: Sipuleucel-T, uma imunoterapia celular autóloga, indicada para pacientes selecionados com CPRC metastático assintomático ou minimamente sintomático.
- Radiofármacos: O Rádio-223 (dicloridrato de rádio-223), um radioisótopo emissor de partículas alfa que se direciona preferencialmente para metástases ósseas, é indicado para pacientes com CPRC, metástases ósseas sintomáticas e sem metástases viscerais conhecidas.
A escolha e o sequenciamento destas terapias são complexos e exigem uma abordagem individualizada. Fatores determinantes na decisão clínica incluem as terapias prévias utilizadas pelo paciente, a extensão (volume) e localização da doença metastática (distinguindo doença predominantemente óssea de doença visceral), a sintomatologia associada, o estado geral de saúde e performance status do paciente, e, crescentemente, as características moleculares do tumor, quando disponíveis.
Papel da Quimioterapia, Terapias Adicionais e Considerações Finais no Câncer de Próstata Avançado
No cenário de progressão da doença após a terapia de privação androgênica (TPA), ou em casos de doença intrinsecamente agressiva, a quimioterapia citotóxica assume um papel terapêutico definido. Agentes como docetaxel e cabazitaxel são estabelecidos para o tratamento do Câncer de Próstata Resistente à Castração (CPRC), visando o controle da progressão tumoral.
Estratégias Terapêuticas Pós-Terapia de Deprivação Androgênica
O manejo da doença que progride apesar da TPA (CPRC) envolve a implementação de estratégias terapêuticas subsequentes, escolhidas com base nas características da doença e do paciente:
- Terapias Hormonais de Segunda Geração: Agentes como abiraterona, enzalutamida e apalutamida são fundamentais neste estágio. Atuam como inibidores potentes da via do receptor de andrógeno (RA), sendo tipicamente empregados após a falha da castração farmacológica ou cirúrgica inicial. Podem ser sequenciados ou, em alguns casos, combinados com TPA, dependendo do contexto clínico.
- Quimioterapia Citotóxica: Conforme mencionado, docetaxel e cabazitaxel são utilizados no CPRC, com cabazitaxel frequentemente considerado após progressão ao docetaxel.
- Outras Modalidades Terapêuticas para CPRC: Terapias adicionais podem ser consideradas em cenários específicos do CPRC, incluindo:
- Imunoterapia celular autóloga (Sipuleucel-T).
- Radiofármacos direcionados a metástases ósseas (Rádio-223), particularmente em pacientes com metástases ósseas sintomáticas.
- Adição de Antiandrogênicos: A incorporação de antiandrogênicos à TPA pode ser considerada como uma manobra terapêutica durante a evolução da doença resistente.
Considerações Clínicas e Fatores Prognósticos
- Impacto da Obesidade: Evidências científicas associam a obesidade e o excesso de gordura corporal a um risco aumentado de desenvolvimento de câncer de próstata avançado ou de fenótipo mais agressivo. Postula-se que o tecido adiposo excessivo possa influenciar vias hormonais e inflamatórias que favorecem o crescimento tumoral e a progressão metastática.
- Individualização Contínua do Tratamento: Reafirma-se a necessidade crucial de uma abordagem terapêutica rigorosamente individualizada para o câncer de próstata avançado e metastático, especialmente na fase de CPRC. A seleção e o sequenciamento das terapias devem considerar continuamente o estado geral do paciente, a extensão e o ritmo de progressão da doença, e as terapias previamente administradas. O manejo adequado visa a otimização dos desfechos oncológicos e da qualidade de vida.